
科目: 来源: 题型:022
在一定条件下,RO![]() 和I-发生反应的离子方程式为:
和I-发生反应的离子方程式为:
RO![]() +6I-+6H+══R-+3
+6I-+6H+══R-+3![]()
![]() I2+3H2O
I2+3H2O
(1)RO![]() 中R元素的化合价是________。
中R元素的化合价是________。
(2)R元素的原子最外层电子数是________。
(3)比较R-和I-两种离子的还原性大小________。
查看答案和解析>>
科目: 来源: 题型:022
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,试纸显红色;②取溶液少许,加入铜片和浓硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有沉淀生成,继续加入过量氨水,沉淀不消失;④取溶液少许,滴入氯化钡溶液产生白色沉淀;⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失(提示:Cu与HNO3反应生成NO,NO遇空气变红棕色)。
请回答下列问题:
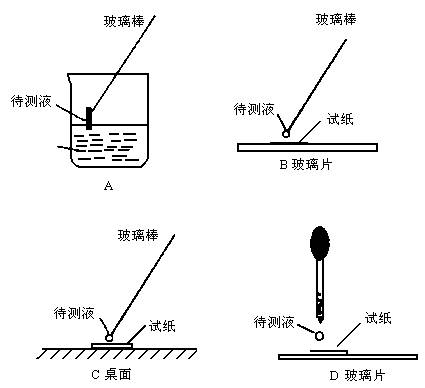
(1)在实验①中,下图所示的操作正确的是__________________(填代号、多填倒扣分)。
(2)根据上述实验判断原溶液中肯定存在的离子是________________肯定不存在的离子是________________________。
(3)写出与②③④三个实验有关的离子方程式
②________________________
③________________________
④________________________
查看答案和解析>>
科目: 来源: 题型:022
用![]() 和HCl溶液作试剂,除去NaCl溶液中含有的少量Ca2+和
和HCl溶液作试剂,除去NaCl溶液中含有的少量Ca2+和![]() 。每种试剂不得重复用两次。提纯过的溶液中除了Na+、Cl-、H+和OH-外,不得遗留任何其他离子。
。每种试剂不得重复用两次。提纯过的溶液中除了Na+、Cl-、H+和OH-外,不得遗留任何其他离子。
(1)写出加入试剂的顺序。
(2)写出各步反应的离子方程式。
查看答案和解析>>
科目: 来源: 题型:022
用氯气对饮用水消毒已有百年历史。由于用Cl2对自来水消毒能导致二噁英的生成,目前采用只具氧化作用的二氧化氯(ClO2)作自来水的消毒剂。
(1)ClO2是一种易爆、易分解的气体,因此通常现制、现用,其原理是用SO2还原KClO3,试写出生成Cl2的化学方程式____________________________________________________。
(2)使用ClO2作饮用水消毒剂的优点是__________________________________________。
(3)目前欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2的体积为ClO2体积的一半。表示这一过程的化学方程式___________________________________。
(4)我国最近研究成功用Cl2氧化亚氯酸钠(在N2保护下)制得ClO2,表示这一反应的化学方程式________________,该法的优点是________________________________________。
(5)ClO2也可以用于纸浆等的漂白,同样不会生成二噁英类化合物,因此被称为“绿色试剂”。除ClO2外,还有一些物质也可作为“绿色试剂”应用于自来水消毒、纸浆漂白,下列物质可能是(填代号)( )
A.SO2 B.H2O
C.HNO3 D.O3
查看答案和解析>>
科目: 来源: 题型:022
有A、B两种无机盐,式量都是120,A的焰色为紫色,B的焰色为黄色。为了确定A和B,将它们溶于水制成溶液,并进行如下实验:①将两种溶液混合有无色刺激性气味的气体产生;②在两种溶液中分别加入BaCl2溶液,A溶液中无沉淀产生,B中有白色沉淀析出;③在两种溶液中分别加入足量Ba(OH)2溶液,均有白色沉淀析出。请填写以下空白:
(1)A是________,B是________。(填写化学式)
(2)实验①的离子方程式是________________________________。
(3)实验③的离子方程式是________________________________。
查看答案和解析>>
科目: 来源: 题型:022
超氧化物歧化酶SOD(本题用E为代号),是生命体中的“清道夫”,在它的催化作用下,生命体代谢过程中产生的超氧离子(O2-)才不致过多积存而毒害细胞使人过早衰老。超氧离子在催化剂SOD存在下发生了如下反应,请完成该反应的离子方程式:
![]()
查看答案和解析>>
科目: 来源: 题型:022
空气质量越来越受到人们的关注,下表是我省部分城市空气质量周报:
城市 污染指数 首要污染物 空气质量等级
济南 98 SO2 Ⅱ
青岛 47 Ⅰ
淄博 103 TSP Ⅲ
潍坊 90 NOx Ⅱ
注:TSP—总悬浮颗粒物;NOx—氮氧化物
(1)由上表可知,最容易出现酸雨的城市是________。
(2)悬浮颗粒不易沉降,它与空气中的SO2、O2接触时,SO2会部分转化为SO3,悬浮颗粒物所起的作用是________。(填序号)
A.氧化剂 B.还原剂
C.催化剂 D.吸附剂
(3)氮的氧化物也是大气污染物之一。目前,治理NO的方法是在一定条件下用氨把一氧化氮还原为氮气和水。科学家又设想,在相同条件下可采用价格比NH3更便宜的天然气来处理NO,可得到同样效果,写出该反应的化学方程式_________________________________________________________________________。
(4)某中等城市每年燃煤约3´106t,其含硫量按1.00%计算,若硫全部转化为SO2,SO2有60.0%转化为硫酸,相当于生成多少吨98.0%的硫酸?
(列式计算)
查看答案和解析>>
科目: 来源: 题型:022
在一定条件下,将含有等体积的H2、CO、CO2的混合气体,通过装有足量还原铁粉、Fe3O4和Na2O2三个反应管。假设气体通过每个反应管都能充分反应,且三个反应管以任意顺序排列。问:
(1)混合气体是否可能被完全吸收________。
(2)尾气是否可以是单一气体?________。若可能,该气体是________。
(3)原混合气体中哪一种气体不可能在尾气中出现?________________。
查看答案和解析>>
科目: 来源: 题型:022
如图所示是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体。供选用的试剂有:A.浓H2SO4,B.浓HCl,C.食醋,D.MnO4,E.H2O2,F.KClO3,G.KMnO4溶液。试回答:
(1)若要快速制备少量氧气,应选择________(填答案标号)。
(2)若要快速制少量HCl,应选择________(填答案标号)。

查看答案和解析>>
科目: 来源: 题型:022
图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。
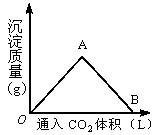
试回答:
OA段曲线和AB段曲线所表示的反应方程式是:
OA________________________;
AB________________________。
A点时已参加反应的CO2和Ca(OH)2的物质的量之比为________________。
B处溶液中存在浓度较大的两种离子是________和________。(填离子符号)
将B处生成的溶液煮沸,可见到的现象是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com