
科目: 来源: 题型:022
针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2![]() H2O+O2
H2O+O2
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
①H2O2仅体现氧化性的反应是(填代号)_____________,该反应配平的化学方程式是_____________________________。
②H2O2既体现氧化性又体现还原性的反应是(填代号)__________。
③H2O2体现弱酸性的反应是(填代号)___________,其理由是___________。
查看答案和解析>>
科目: 来源: 题型:022
地球外层空间存在着臭氧(O3)和氧原子。该臭氧层的存在能吸收和阻挡太阳有害的强烈紫外辐射。可是人为的大气污染物会破坏臭氧层,如超音速飞机排放物中的氮氧化物(NO和NO2),它们和O3及O发生如下反应:O3+NO→NO2+O2;O+NO2→NO+O2,这两个反应反复循环,其总反应式为_________________。由此可见氮氧化物在破坏臭氧层的过程中起了___________________的作用。
查看答案和解析>>
科目: 来源: 题型:022
如图所示,在两个燃烧匙内分别盛放足量的红磷和硫,点燃后分别放入两个集气瓶内,迅速盖紧瓶塞,待红磷和硫燃烧停止后,打开止水夹,B烧杯内的水很快进入________瓶,而不进入瓶,进入的水约占瓶容积的________,原因是_________________________。
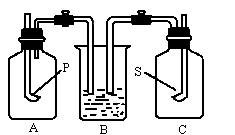
查看答案和解析>>
科目: 来源: 题型:022
第Ⅳ主族元素R,在它的化合物R(OH )n中,其质量分数为0.778,在它的另一种化合物R(OH )m中,其质量分数为0.636。
(1)试求n和m的值:n=________,m=________。
(2)试求R的相对原子质量Ar =________。
查看答案和解析>>
科目: 来源: 题型:022
不同元素的气态原子失去最外层的1个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:_________________。各主族中E值的这种变化特点体现了元素性质的________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别的E值出现反常现象。试预测下列关系式中正确的是________。(填写编号,多选倒扣分)
A.①E(砷)>E(硒) B.②E(砷)<E(硒)
C.③E(溴)>E(硒) D.④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层的1个电子所需能量E值的范围:________<E<________。
(4)10号元素E值较大的原因是________。
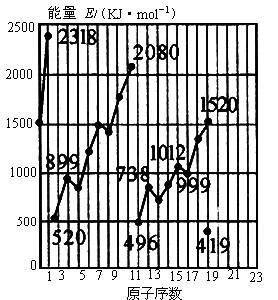
查看答案和解析>>
科目: 来源: 题型:022
(1)下列结构图中(见图)●代表原于序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键(示例:![]() )。
)。
根据各图表示的结构特点,写出该分子的化学式:
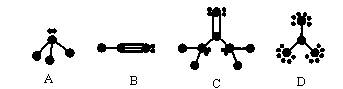
A:________________B:________________
C:________________D:________________
(2)化合物A是一种不稳定的物质,其分子组成可表示为OxFy。已知10mLA气体能分解生成15mLO2和10mLF2(气体体积在相同条件下测定),试写出:
①A的化学式________________,推断依据是________________。
②若A的分子中x个原子呈…O—O—O…链状排列。则A分子的电子式是________________,结构式是________________。
查看答案和解析>>
科目: 来源: 题型:022
(1)已知下列元素的原子半径:
元素 N S O Si
原子半径/10-10m 0.75 1.02 0.74 1.17
根据以上数据,磷原子的半径(10-10m )可能的范围是________。
(2)X,Y是第1周期以外的短周期元素,它们可以形成化合物XmYn,且离子均具有稀有气体原子的电子层结构,则X,Y原子序数a,b的关系可表示为________、________、________。
查看答案和解析>>
科目: 来源: 题型:022
用A.质子数,B.中子数,C.核外电子数,D.最外层电子数,E.电子层数,填写下列空格。
(1)核素种类由________决定,
(2)元素种类由________决定,
(3)元素同位素由________决定,
(4)同位素相对原子质量由________决定,
(5)元素的原子半径由________决定,
(6)元素的化合价主要由________决定,
(7)元素的化学性质主要由________决定,
(8)价电子数通常指________,
(9)核电荷数由________决定。
查看答案和解析>>
科目: 来源: 题型:022
根据周期律对角线规则,金属Be与铝单质及其化合物的性质相似。又知AlCl3熔、沸点较低,易升华。试回答下列问题:
(1)试比较Be2+,Li+,H+微粒半径的大小:________<________<________。
(2)写出BeO与NaOH溶液反应的离子方程式(生成Na2BeO2):________。
(3)Be(OH )2和Mg(OH )2可用试剂________鉴别,其离子方程式为__________________。
(4)BeCl2是________________(填“离子化合物”或“共价化合物”)。
查看答案和解析>>
科目: 来源: 题型:022
在1~18号元素中,除稀有气体元素外,选择化学用语填空:
(1)原子半径最大的元素是______________;
(2)原子半径最小的元素是_____________,其次是______________;
(3)单质的还原性最强的元素是_______________;
(4)单质的氧化性最强的元素是_______________;
(5)单质为有色气体的元素是_________________;
(6)与水反应最剧烈的非金属单质是___________;
(7)某元素的原子既能形成阳离子,也能以原子团形式形成阴离子,该两种离子在溶液中反应的离子方程式为____________;
(8)某元素原子的最外层与次外层电子数之差为2,其低价氧化物不能燃烧,该氧化物若排入空气,则能对空气造成污染,该元素是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com