
科目: 来源:浙江省临海市杜桥中学2011届高三年级上学期九月底月考试题化学试题 题型:022
向盛有KI溶液的试管中加入少许
CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.完成下列填空:
(1)写出并配平
CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):(2)整个过程中的还原剂是________.
(3)把KI换成KBr,则
CCl4层变为________色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是________.(4)加碘盐中含碘量为20 mg~50 mg/kg.制取加碘盐(含KIO3的食盐)1000 kg,若庄Kl与
Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数).查看答案和解析>>
科目: 来源:浙江省临海市杜桥中学2011届高三年级上学期九月底月考试题化学试题 题型:022
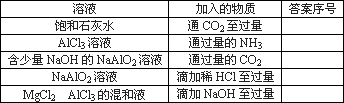
A、B、C、D、E均为可溶于水的固体,组成它们的离子有
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失.
据此推断它们是
A________、B________、C________、D________、E________.
查看答案和解析>>
科目: 来源:浙江省临海市杜桥中学2011届高三年级上学期九月底月考试题化学试题 题型:022
下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从A——E中选择各题要求的序号填入表中
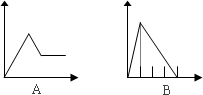
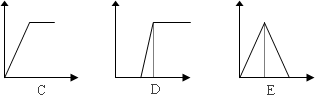
查看答案和解析>>
科目: 来源:浙江省嘉兴市第一中学2011届高三第一次月考化学试题 题型:022
已知NaBH4是一种强还原剂,其中B元素处于最高价态.解决下列问题:
(1)在60年代,德国拜尔药厂用下面的反应把NaBH4的生产发展成工业规模.请将下列反应方程式配平,各物质的计量数填入相应空格中:
________Na2B4O7+________Na+________H2+________SiO2=________NaBH4+________Na2SiO3
上述反应中发生氧化反应的物质有________;
(2)NaBH4极易溶于水并与水反应产生H2,反应后硼以BO2-形式存在,且反应前后硼元素化合价不变,则NaBH4与水反应的离子方程式为________;
如果反应中转移2 mol电子,则可生成标准状况下的H2为________L;
(3)在碱性条件下NaBH4不与水反应,可使许多金属离子还原成原子,反应后硼仍以BO2-形式存在.如在冶金工业中,常用NaBH4处理含Au3+的废液.如要处理800 kg含Au 1.97%的废液,则理论上需NaBH4的质量________g.
查看答案和解析>>
科目: 来源:浙江省嘉兴市第一中学2011届高三第一次月考化学试题 题型:022
已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色.各物质的转化关系如下图(部分反应产物已略去).

请回答下列问题:
(1)X的化学式为________,F的电子式为________
(2)在反应①②③④中属于置换反应的是________(填序号).
(3)反应②的离子方程式为________.
(4)X溶液与F反应的总化学方程式为________.
(5)若向100 mL盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16 g固体C.则滤液A中溶质的物质的量浓度为________.(假设溶液体积不变)
查看答案和解析>>
科目: 来源:浙江省嘉兴市第一中学2011届高三第一次月考化学试题 题型:022
用如下装置可以完成一系列实验(图中夹持装置已略去).

请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:

Ⅱ.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.回答下列问题:
(1)p中盛装试剂的化学式为________.
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式________.①处包有的某固体物质可能是________.
a.MnO2
b.KMnO4
c.KCl
d.Cu
(3)在实验过程中,在③处能观察到________.
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:________.
查看答案和解析>>
科目: 来源:浙江省杭州学军中学2011届高三第一次月考化学试题 题型:022
甲醇汽油是由10%-25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)![]() CH3OH(g) △H=a kj/mol,
CH3OH(g) △H=a kj/mol,
下表是该反应在不同温度下的化学平衡常数(K):
(1)由表中数据判断ΔH a________0(填“>”、“=”或“<”).
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5 mol·L-1,则此时的温度为________℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
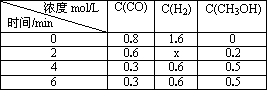
①反应从2 min到4 min之间,H2的反应速率为________.
②反应达到平衡时CO的转化率为________.
③反应在第2 min时改变了反应条件,改变的条件可能是________(填序号).
a.使用催化剂
b.降低温度
c.增加H2的浓度
查看答案和解析>>
科目: 来源:浙江省杭州市萧山九中2011届高三第一次质量检测化学试题 题型:022
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为________.
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________.
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为________mL.
查看答案和解析>>
科目: 来源:浙江省杭州市萧山九中2011届高三第一次质量检测化学试题 题型:022
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失.

请回答下列问题:
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:________,________,________.氢氧化钠溶液能否用氨水代替,为什么?________,________.
(2)溶液a中存在的离子有________;在溶液a中加入盐酸时需要注意________,为什么?________;为此,改进方法是________.
(3)为了研究AlCl3晶体的性质,在得到AlCl3溶液后,如何得到AlCl3晶体?________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com