
科目: 来源:浙江省杭州十四中2010-2011学年高一下学期期中考试化学试题 题型:022
下表为元素周期表的一部分,请回答有关问题:
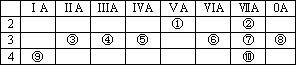
(1)⑤和⑧的元素符号是________和________;
(2)表中最活泼的金属是________,非金属性最强的元素是________(填写元素符号);
(3)表中能形成两性氢氧化物的元素是________,分别写出该元素的氢氧化物与⑥最高价氧化物对应水化物反应的化学方程式:________,
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:________.
(5)0.1 mol的单质⑦与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是:________.
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高一下学期期中考试化学试题 题型:022
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似.试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式________;
(2)Be(OH)2与Mg(OH)2可用________试剂鉴别,其反应离子方程式为________.
(3)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是________;同时还有少量________生成.
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高一下学期期中考试化学试题 题型:022
有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构.回答下列问题:
(1)上述四种元素中C的名称是________;
(2)画出B元素原子的结构示意图________;
(3)写出下列化学方程式:
单质D在单质C中燃烧的化学方程式________;
A的氢氧化物和D的氢氧化物反应的离子方程式________.
查看答案和解析>>
科目: 来源:浙江省南马高级中学2010-2011学年高一下学期期中考试化学试题 题型:022
下表中的实线表示元素周期表的部分边界.①-⑥分别表示元素周期表中对应
位置的元素.

(1)元素⑤氢化物的结构式为________.
(2)元素④的氢化物沸点比元素⑤的氢化物沸点________(填“高”或“低”).原
因是________.
(3)在一定条件下,元素③与⑥可形成一种化合物,常温下为淡黄色液体,则其晶体类型为________;已知该化合物中每个原子都满足稳定结构,写出它的电子式________;该物质遇水剧烈反应,生成两种产物,其中之一的分子构型为三角锥形,另一利物质具有漂白性,写出相关反应的化学方程式________.
查看答案和解析>>
科目: 来源:浙江省南马高级中学2010-2011学年高一下学期期中考试化学试题 题型:022
前20号元素A、B、C、D,A元素所处的周期数、主族序数、原子序数均相等;
B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排
布,两元素可形成化合物D2C.
(1)D元素的名称________;B元素的原子结构示意图________;
(2)C在周期表中的位置________;
(3)化合物D2C的电子式________;
(4)B的氢化物的水溶液加入B的最高价氧化物对应水化物的稀溶液,反应的离子方程式为________;
(5)有人认为,A单质是一种优质能源,你认为它作为能源的优点是________.
查看答案和解析>>
科目: 来源:浙江省兰溪一中2010-2011学年高二下学期期中考试化学试题 题型:022
反应3Fe(S)+4H2O Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是________(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率________,逆反应速率________.
③保持体积不变,充入N2使体系压强增大,其正反应速率________,逆反应速率________.
④保持压强不变,充入N2使容器的体积增大,其正反应速率________,逆反应速率________.
查看答案和解析>>
科目: 来源:浙江省兰溪一中2010-2011学年高二下学期期中考试化学试题 题型:022
A物质的化学式为M(OH)2 ,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2++2OH-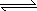 M(OH)2
M(OH)2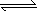 2H++MO22-
2H++MO22-
回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25℃时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-)________,C(H+)________,水的电离度________,Kw________.(2)
25℃时,向A的稀溶液中加入少量的烧碱固体.则
水的电离度________,溶液的pH________.查看答案和解析>>
科目: 来源:河北省冀州中学2010-2011学年高一下学期中考试化学文科试题 题型:022
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ②2CH3CHO+O2![]() 2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
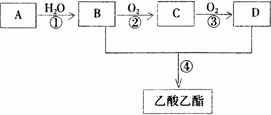
回答下列问题:
(1)B、D分子中的官能团名称分别是________、________.
(2)写出下列反应的反应类型:①________,②________,④________.
(3)写出下列反应的化学方程式:
②________;④________.
查看答案和解析>>
科目: 来源:江西省高安中学2010-2011学年高二下学期期中考试化学试题 题型:022
化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体.可由马铃薯、玉米、淀粉等发酵制得.A的钙盐是人们喜爱的补钙剂之一,A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应,在浓硫酸存在下,A可发生如图所示的反应:
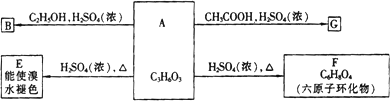
(1)写出化合物A,B,G的结构简式:A________,B________,G________.
(2)写出有关化学方程式.
A→E________;
A→F________;
(3)写出反应类型:A→E________,A→F________.
(4)与A具有相同官能团的同分异构体的结构简式为________.
查看答案和解析>>
科目: 来源:江西省高安中学2010-2011学年高二下学期期中考试化学试题 题型:022
1991年诺贝尔化学奖授予瑞士化学家R.R.Ernst教授,以表彰他在发展高分辨核磁共振波谱学方面的杰出贡献.1H核磁共振谱(PMR)是研究有机化学分子结构的一种重要方法.已知有机化合物中处于同一位置的氢原子(称为等性氢原子)在PMR中为同一组信号峰,谱中峰的强度与分子中给定类型的氢原子数成正比.例如CH2=CHCH2CH3有四种不同位置的氢原子,因此在PMR中有4组信号峰,强度比为2∶1∶2∶3
(1)乙醇(CH3CH2OH)在PMR中可能有________组信号峰,甲醚(CH3OCH3)在PMR中可能有________组信号峰.
(2)在常温下测得某烃C8H10的PMR谱,观察到两种氢原子给出的信号,其强度之比为2∶3,该烃的结构简式可能为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com