
科目: 来源:浙江省杭州十四中2010-2011学年高二下学期期中考试化学试题 题型:022
双氧水(H2O2)和水都是极弱的电解质.
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式________.
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐,请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:________.
(3)水电离生成H3O+和OH-叫做水的自偶电离.双氧水同水一样,也有极微弱的自偶电离,其自偶电离的方程式为________.
(4)除了过氧化氢跟碱的反应外,请你再写出一个可表明双氧水是弱酸的反应的化学方程式________.
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高二下学期期中考试化学试题 题型:022
在温度为830°K时,下列可逆反应具有某些特殊性质:CO+H2O![]() H2+CO2若起始浓度[CO]为2 mol/L、[H2O]=3 mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6 mol/L,则CO的转化率为75%.请注意上述有关数据,并总结出规律,完成下列问题:
H2+CO2若起始浓度[CO]为2 mol/L、[H2O]=3 mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6 mol/L,则CO的转化率为75%.请注意上述有关数据,并总结出规律,完成下列问题:
设830°K时,起始浓度c(CO)为amol/L、c(H2O)为bmol/L,反应达到平衡时c(H2)为cmol/L.
(1)当b不变时,a减少,重新达到平衡时,CO的转化率________,H2O的转化率________(填“上升”、“下降”或“不变”)
(2)当a=5,c=![]() 时,b=________
时,b=________
(3)当a=b时,![]() =________
=________
(4)用以表示a、b、c之间关系的代数式是________
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高二下学期期中考试化学试题 题型:022
25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b.则:
(1)a值可否等于3(填“可”或“否”)________,其理由是________.
(2)a值可否等于5(填“可”或“否”)________,其理由是________.
(3)a的取值范围________.
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高二下学期期中考试化学试题 题型:022
从某铝镁合金片上剪下一小块(质量为1.0 g),立即投入到盛有10 mL 10 mol/L NaOH溶液的小烧杯中.
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象.(请依次写出)
(2)开始时产生气泡的速率较慢的原因是________.
后来的反应速率相当快的原因是________.
(3)写出所形成的原电池的负极材料名称:________
和电极反应式:________
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据.(请逐一写出)
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高二下学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高二下学期期中考试化学试题 题型:022
已知
HCO(1)
向NaHCO3溶液中滴加少量溴水:________(2)
向Na2CO3溶液中滴加少量溴水:________查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高一下学期期中考试化学试题 题型:022
已知元素的电负性和原子半径等内容一样,也是元素的一种基本性质.下面给出14种元素的电负性:

试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是________;
(2)根据你的理解,元素的电负性指________;
(3)预测Br和I元素电负性的大小关系________.
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高一下学期期中考试化学试题 题型:022
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A的最高价氧化物对应的水化物是________(填化学式);
(2)物质E中所包含的化学键有________,写出C、D两元素形成的化合物C2D的电子式________;
(3)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为________.
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高一下学期期中考试化学试题 题型:022
某元素的同位素![]() ,它的氯化物XCl2 1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应.若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 1.11 g溶于水制成溶液后,加入1 mol/L的AgNO3溶液20 mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值________和A值________;
(2)X元素在周期表中的位置________;
(3)写出XCl2的电子式________.
查看答案和解析>>
科目: 来源:浙江省杭州十四中2010-2011学年高一下学期期中考试化学试题 题型:022
已知有关物质的熔、沸点数据如下表:
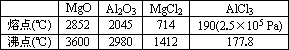
(1)工业上常用电解熔融MgCl2的方法生产金属镁;用电解Al2O3与冰晶石熔融混合物的方法生产铝.不用电解MgO的方法生产镁的原因是:________;AlCl3可能为________晶体.
(2)请设计可靠的实验证明MgCl2、AlCl3所属化合物的类型,其实验方法是________.
(3)AlCl3具有以下________特殊性质(请填序号).
①液化
②挥发
③升华
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com