
科目: 来源:山东省微山一中2010-2011学年高一下学期期末考试化学试卷 题型:022
将气体
A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)(
1)用C表示10 s内正反应的平均反应速率为:________;(
2)反应前A的物质的量浓度是:________;(
3)10 s末,生成物D的浓度为________;(
4)平衡后,若改变下列条件,生成D的速率如何变化(用“增大”、“减小”或“不变”填空).
查看答案和解析>>
科目: 来源:山东省微山一中2010-2011学年高一下学期期末考试化学试卷 题型:022
A
、B、C和D等4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.(1)B
在周期表中的位置第________周期,第________族;(2)A
、B形成的化合物的电子式________;(3)C
的元素名称________,C的最高价氧化物的化学式________;(4)D
的最高价氧化物对应的水化物的化学式________.查看答案和解析>>
科目: 来源:山东省威海市2010-2011学年高一下学期期末模块考试化学试卷 题型:022
将质量相等的锌片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如下图的装置.

(1)此装置为________,该装置中发生反应总的离子方程式为________,铜片周围溶液会出现________的现象.
(2)若2 min后测得锌片质量减少1.3 g,则导线中流过的电子为________mo1.
(3)该装置的电解质溶液还可以用________(答一种即可).
查看答案和解析>>
科目: 来源:山东省威海市2010-2011学年高一下学期期末模块考试化学试卷 题型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:吉林省油田高中2010-2011学年高二下学期期初考试化学试题 题型:022
由乙烯和其他无机原料合成环状化合物其合成过程如下(水及其他无机产物均已省略):
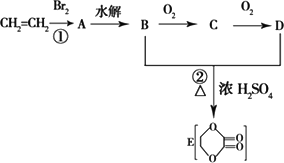
请分析后回答下列问题:
(1)反应的类型分别是①________、②________;
(2)D物质中的官能团为________;
(3)C物质的结构简式________;
(4)物质X与A互为同分异物体,则X的结构简式为________.
(5)A→B的化学方程式(注明反应条件)________.
查看答案和解析>>
科目: 来源:吉林省油田高中2010-2011学年高二下学期期初考试化学试题 题型:022
下列实验操作不正确的是________.
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复多次,完成乙醇氧化为乙醛的实验;
C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇;
D.向试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,加热制取乙酸乙酯;
E.实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流.
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加,至沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
查看答案和解析>>
科目: 来源:北京市日坛中学2010-2011学年高一下学期期中考试化学试题 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:北京市日坛中学2010-2011学年高一下学期期中考试化学试题 题型:022
A、B、C、D、E为短周期元素,A——E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素.试回答:
(1)写出下列元素符号:A________,B________,D________.
(2)化合物A2C2的电子式是________;请用电子式表示化合物D2C的形成过程________.
(3)E单质与Fe和稀硫酸构成的原电池中,Fe是________极,另外一个电极上的电极反应式为________.
(4)将D单质投入A2C中的离子方程式________.
查看答案和解析>>
科目: 来源:北京市日坛中学2010-2011学年高一下学期期中考试化学试题 题型:022
(1)选择适宜的材料和试剂以下面的化学反应原理设计一个原电池,
2FeCl3+Cu=CuCl2+2FeCl2
①画出装置图;并在图中标出正负极
②写出电极反应式:
正极:________;负极:________.
③电解质溶液中阳离子向________极移动
查看答案和解析>>
科目: 来源:北京市日坛中学2010-2011学年高一下学期期中考试化学试题 题型:022
短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素.A、C
位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.请回答下列问题:
(1)D在元素周期表中的位置是________,其最高价氧化物对应水化物的名称为________.
(2)A、B、C三种元素组成的化合物的电子式为________,其中含有的化学键类型为________;该化合物与D单质发生化学反应的离子方程式为________,当反应中转移0.2 mol电子时,参加反应的D单质的体积(标准状况)为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com