
科目: 来源:黑龙江省哈六中2010-2011学年高二下学期期末考试化学试题 题型:022
生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
(1)上述反应的催化剂含有Cu、Zn、Al等元素.写出基态Al原子的价电子排布图________.
(2)根据等电子原理,写出CO分子结构式________.
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀.
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子中碳原子轨道的杂化类型为________.
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________.
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________.

查看答案和解析>>
科目: 来源:黑龙江省哈六中2010-2011学年高二下学期期末考试化学试题 题型:022
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1.
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________、________;杂化轨道分别是________、________;a分子的立体结构是________.
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________晶体、________晶体.
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)________.
(4)Y与Z比较,电负性较大的________,其中W+2价离子的核外电子排布式是________.
查看答案和解析>>
科目: 来源:黑龙江省哈六中2010-2011学年高二下学期期末考试化学试题 题型:022
某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
A.KI溶液
B.淀粉溶液
C.NaOH溶液
D.稀H2SO4
E.氯水
发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色.依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号)________.
(2)①→②反应的化学方程式为________.
(3)溶液由棕黄色变为蓝色的原因是________.
(4)③→④反应的化学方程式为________.
查看答案和解析>>
科目: 来源:江西省白鹭洲中学2011-2012学年高二第一次月考化学试题 题型:022
将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,发生反应:2SO2+O2![]() 2SO3(正反应放热).达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过某溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)请回答下列问题:
2SO3(正反应放热).达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过某溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是________.(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是________.(填字母)
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.升高温度
(3)求该反应达到平衡时SO3的转化率________(用百分数表示).
查看答案和解析>>
科目: 来源:江西省白鹭洲中学2011-2012学年高二第一次月考化学试题 题型:022
已知下列热化学方程式:
①CaCO3(s) CaO(s)+CO2(g)
CaO(s)+CO2(g)
②C(s)+H2O(s) CO(g)+H2(g)
CO(g)+H2(g)
③![]() H2SO4(l)+NaOH(l)
H2SO4(l)+NaOH(l)
![]() Na2SO4(l)+H2O(l)
Na2SO4(l)+H2O(l)
④C(s)+O2(g) CO2(g) ΔH=-393.5 kJ/mol
CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+![]() O2(g)
O2(g) CO2(g) ΔH=-283 kJ/mol
CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq) NaNO3(aq)+H2O(l) ΔH=-57.3 kJ/mol
NaNO3(aq)+H2O(l) ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g) 2H2O(l)
2H2O(l)
(1)上述热化学方程式中,不正确的有________,不正确的理由分别________.
(2)根据上述信息,写出C转化为CO的热化学方程式:________.
(3)上述反应中,表示燃烧热的热化学方程式有________;表示中和热的热化学方程式有________.(填序号)
(4)已知0.5 mol甲烷与0.5 mol水蒸气在t℃.p kPa时,完全反应生成一氧化碳和氢气,吸收了a kJ热量,该反应的热化学方程式是:________.
查看答案和解析>>
科目: 来源:新疆乌鲁木齐八中2010-2011学年高二第一次月考化学试题(平行班) 题型:022
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态金属氧化物,A为常见金属,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:

(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置________,
(2)写出检验D溶液中阳离子的方法________.
(3)写出反应④的离子方程式________.
(4)若28 gA单质在足量的氧气中点燃,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式:________;
查看答案和解析>>
科目: 来源:新疆乌鲁木齐八中2010-2011学年高二第一次月考化学试题(平行班) 题型:022
X、Y、Z、W四种短周期元素在周期表中的位置关系如图
![]()
Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为________.
(2)Y和Z元素可组成的化合物的化学式为________.
(3)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为________.
(4)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式________.
Ⅱ.若Y和Z的核外电子数之和为22
(1)Y的气态氢化物电子式为________,工业合成该物质的化学方程式为________.
(2)将X的最高价氧化物通入到硅酸钠溶液中,实验现象是________.
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4 mol时,产生气体体积(标准状况下)是________.
查看答案和解析>>
科目: 来源:新疆乌鲁木齐八中2010-2011学年高一下学期期末考试化学试题 题型:022
某芳香烃中含碳元素的质量分数为90.6%,相同条件下,其蒸气密度为空气密度的3.66倍(M空气设为29).
(1)该烃的分子式为________.某最简单的同系物中能使酸性高锰酸钾溶液褪色的是(写出其结构简式)________.
(2)若该烃硝化时,苯环上的一硝基取代物有三种,则该烃的结构简式可能为________.
查看答案和解析>>
科目: 来源:新疆乌鲁木齐八中2010-2011学年高一下学期期末考试化学试题 题型:022
随着现代工业的发展,能源问题已经越来越引起人们的重视,科学家预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂可以水解成葡萄糖,再将葡萄糖转化为乙醇,用做燃料.
(1)写出绿色植物的秸秆转化为乙醇的化学方程式:
①________
②________.
(2)乙醇除用做燃料外,还可以用它合成其他有机物,以乙醇为起始原料的转化关系如图所示:(已知;在有催化剂的条件下,多步氧化R-CH2OH→R-CHO→RCOOH)
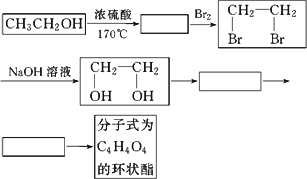
请在方框中填上相应物质的结构简式.
(3)写出上面转化关系图中由CH2OHCH2OH→C4H4O4的化学方程式(有机物用结构简式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com