
科目: 来源:山东省济宁市重点中学2011-2012学年高二上学期期中考试化学试题 题型:022
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)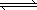 CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7J·(K·mol)-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7J·(K·mol)-1
①该反应能否自发进行与________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同).
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v
正(CO)=v逆(H2O)d.c(CO)=c(H2)
(2)
将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)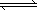 CO2(g)+H2(g),
CO2(g)+H2(g),

①实验1中以v(CO2)表示的反应速率为________.
②该反应的逆反应为________(填“吸”或“放”)热反应
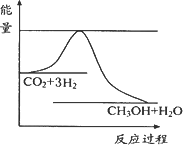
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)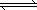 CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化.在体积为1 L的
CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化.在体积为1 L的
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目: 来源:陕西省师大附中2011-2012学年高一上学期期中考试化学试题 题型:022
(1)向Ba(HCO3)2溶液中滴加少量的NaOH溶液,请写出发生反应的离子方程式:________;在以上溶液中继续滴加NaOH溶液至过量,请写出此步反应的离子方程式:________.
(2)
在氯化钾与氯化钙的混和物中,钾离子与钙离子的物质的量之比为1∶2,则该混合物中KCl的质量分数为________;含有1 mol氯离子的该混合物的质量为________.查看答案和解析>>
科目: 来源:辽宁省沈阳二中2011-2012学年高二上学期期中考试化学试题 题型:022
某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)________25℃.若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________.
②若所得混合液的pH=2,则a∶b=________.此溶液中各种离子的浓度由大到小排列顺序是________.
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2011-2012学年高二上学期期中考试化学试题 题型:022
常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+).(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=________mol/L;c(H+)-c(MOH)=________mol/L.
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度________MCl的水解程度.(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2011-2012学年高二上学期期中考试化学试题 题型:022
已知T℃、P kPa时,在容积为V L密闭容器内充有1 mol A和1 mol B.保持恒温恒压,使反应:A(g)+B(g) C(g)达到平衡时,C的体积分数为40%.试回答有关问题:
C(g)达到平衡时,C的体积分数为40%.试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2 mol C,则反应达到平衡时,容器的容积为________,C的体积分数为________.
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1 mol A和1 mol B反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为________.
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2011-2012学年高二上学期期中考试化学试题 题型:022
在10℃和2×105 Pa的条件下,反应aA(g)+bB(g)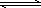 cC(g)建立平衡后再逐步增大体系的压强(温度不变).下表列出了不同压强下反应建立平衡时物质A的浓度:
cC(g)建立平衡后再逐步增大体系的压强(温度不变).下表列出了不同压强下反应建立平衡时物质A的浓度:
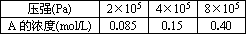
根据表中数据回答:
(1)压强从2×105 Pa增加到4×105 Pa时,平衡向________反应方向移动(填“正”、“逆”).
(2)压强从4×105 Pa增加到8×105 Pa时,平衡向________反应方向移动(填“正”、“逆”),可能原因是________.
(3)在10℃和2×105Pa的条件下,能作为该反应达到化学平衡状态的依据是________.
a.容器中气体的密度不变
b.混合气体中c(A)不变
c.v正(A)·b=v逆(B)·a
d.混合气体的平均相对分子量不变
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2011-2012学年高二上学期期中考试化学试题 题型:022
对于可逆反应N2(g)+3H2(g)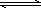 2NH3(g) ΔH<0,下列研究目的和示意图相符的是:________
2NH3(g) ΔH<0,下列研究目的和示意图相符的是:________

查看答案和解析>>
科目: 来源:福建省厦门六中2011-2012学年高二上学期期中考试化学理科试题 题型:022
氮元素可以形成多种化合物.回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是________.
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮化物.
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)![]() 3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1
3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1
若该反应中有4 mol N-H键断裂,则形成的π键有________mol.
②肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体![]() 内不存在
内不存在![]() ________(填标号)
________(填标号)
a.离子键
b.共价键
c.配位键
d.范德华力
(3)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体得4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.下列分子或离子中,能被该有机化合物是别的是________(填标号).
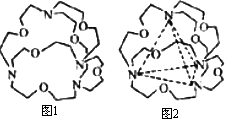
a.CF4
b.CH4
c.NH4+
d.H2O
查看答案和解析>>
科目: 来源:福建省厦门六中2011-2012学年高二上学期期中考试化学理科试题 题型:022
有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)写出A、B、C、D、E5种元素的元素符号
A是________
B是________
C是________
D是________
E是________
(2)D元素在周期表中的位置为________.
(3)用电子排布式表示B元素原子的价电子构型________![]() .
.
(4)元素的电负性的大小关系是B________D,(填“>”、“<”或“﹦”),C与E的第一电离能的大小关系是C________E(填“>”、“<”或“﹦”).
(5)A2D属于________(填“极性”或“非极性”)分子,其分子的空间构型为________.
(6)D、E元素形成的化合物为________晶体,电子式为________.
查看答案和解析>>
科目: 来源:福建省厦门六中2011-2012学年高二上学期期中考试化学理科试题 题型:022
m、n、x、y四种主族元素在周期表的相对位置如下图所示.
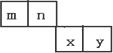
已知它们的原子序数总和为46,则:
(1)元![]() 素n的气态氢化物的分子式为________,空间构型为________,中心原子的杂化类型是________.n原子的价电子排布式是________
素n的气态氢化物的分子式为________,空间构型为________,中心原子的杂化类型是________.n原子的价电子排布式是________
(2)m与y所形成的化合物含________键,属________分子.(填“极性”或“非极性”)
(3)x位于周期表的第________周期第________族;其简单离子的离子结构示意图为________.
(4)由n、y的氢化物相互作用所生成的物质的电子式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com