
科目: 来源:吉林省长春市十一中2011-2012学年高一上学期期中考试化学理科试题 题型:022
阅读下列材料后,回答相应问题.
一个体重50 Kg的健康人大约含铁2 g,这2 g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在.二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4).服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收.
(1)人体中经常进行Fe2+![]() Fe3+的相互转化,在A过程中,Fe2+做________剂,在B过程中,Fe3+做________剂.
Fe3+的相互转化,在A过程中,Fe2+做________剂,在B过程中,Fe3+做________剂.
(2)“服用维生素C,可使食物中三价铁离子还原成二价铁离子.”这句话指出,维生素C在这一反应中做________剂,具有________性.
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向0.2 mol/L 1 L FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________.
查看答案和解析>>
科目: 来源:吉林省长春市十一中2011-2012学年高一上学期期中考试化学理科试题 题型:022
离子反应方程式书写:
(1)用盐酸中和烧碱,请写出其反应的离子方程式:________.
(2)用稀硫酸清洗铁锈(Fe2O3),请写出其反应的离子方程式:________.
(3)用足量的澄清石灰水检验二氧化碳,请写出其反应的离子方程式:________.
(4)小苏打能治疗胃酸(主要是盐酸)过多,请写出其反应的离子方程式:________.
(5)金属铝能与氢氧化钠溶液发生反应,请写出其反应的离子方程式:________.
查看答案和解析>>
科目: 来源:贵州省遵义四中2011-2012学年高二上学期期末检测化学试题 题型:022
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用煤的汽化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的汽化的主要化学方程式为________.
(2)利用水煤气合成二甲醚的总反应式可表示为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(3)已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
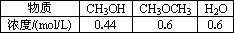
①通过计算比较此时正、逆反应速率的大小?
②若加入CH3OH后,经10 min反应达到平衡,试计算此时CH3OH的物质的量浓度和该时间内CH3OH的化学反应速率?
查看答案和解析>>
科目: 来源:贵州省遵义四中2011-2012学年高二上学期期末检测化学试题 题型:022
日常生活中常见的金属材料有铝合金、钢铁等,某化学实验小组欲测定几种金属材料的耐腐蚀性,所用药品和试剂有:铝合金、钢铁、CO2、SO2、水.
(1)请完成以下实验设计表,并在实验目的的一栏中填入对应的实验编号:

(2)在10%的盐酸中温度对铝合金的腐蚀速率影响关系见下图:铝合金在40℃时的腐蚀速率是20℃的________倍.
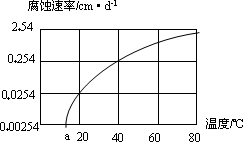
(3)请在上题图象中,画出铝合金在CO2溶液和SO2溶液中腐蚀速率随温度变化关系的预期结果示意图(都从a点开始).
查看答案和解析>>
科目: 来源:贵州省遵义四中2011-2012学年高二上学期期末检测化学试题 题型:022
已知25℃、101 kPa下,氢气、甲烷和葡萄糖的燃烧热依次为285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol.
(1)0.1 mol甲烷和0.2 mol氢气组成的混合气体在25℃、101 kPa下完全燃烧释放的热量为________;
(2)写出表示葡萄糖燃烧热的热化学方程式:________;
(3)有人利用甲烷和氧气的反应设计成如图所示燃料电池,若使用酸性电解质溶液,则两极的电极反应式为:
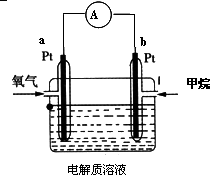
a极:________,b极:________;若使用碱性电解质溶液,则b极的电极反应式为:b极:________;放电时电极a作________极,外电路中电流从________流向________,电解质溶液中阳离子移向________极;
查看答案和解析>>
科目: 来源:贵州省遵义四中2011-2012学年高二上学期期末检测化学试题 题型:022
在
Cl-、Al3+、HSO4-、K+、HS-五种离子中,既不能电离又不能水解的离子是________,只能水解不能电离的离子是________,只能电离不能水解的离子是________,既能电离又能水解的离子是________,能促进水电离的离子是________,能抑制水的电离的离子是________,写出阴离子水解的离子方程式________.查看答案和解析>>
科目: 来源:贵州省遵义四中2011-2012学年高一上学期期末检测化学试题 题型:022
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
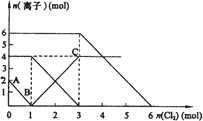
已知:2Fe2++Br2![]() 2Fe3++2Br-
2Fe3++2Br-
2Fe3++2I-![]() 2Fe2++I2
2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为________.
(2)当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:________.
(3)原混合溶液中FeBr2的物质的量为________.
(4)原溶液中:c(Fe2+)∶c(I-)∶c(Br-)=________.
查看答案和解析>>
科目: 来源:贵州省遵义四中2011-2012学年高一上学期期末检测化学试题 题型:022
干燥的氨气可与________等液体物质(至少选填两种)一起组装成功喷泉实验;向烧杯中的FeSO
4溶液中滴加NaOH溶液,然后烧杯静置在空气中,可观察到的现象是________;有关反应的化学方程式或离子方程式为:①________②________;向新制氯水中滴加AgNO溶液,现象是________,相应的离子方程式为①________②________;查看答案和解析>>
科目: 来源:河南省卢氏一高2012届高三上期期末调研考试化学试题 题型:022
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)![]() S(g)+2CO2(g)
S(g)+2CO2(g)
(1)已知:CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(g)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
试写出利用上述方法处理烟道气的热化学方程式
________(2)
在容积为2 L的密闭容器中,充入4 mol CO和2 mol SO2,在一定条件下发生反应2CO(g)+SO2(g)
①0-2 min内的平均反应速率v(CO)=________.
②该温度下,上述反应的平衡常数K=________(填数值).
③2 min后改变下列条件能使上述反应的反应速率增大,且平衡向正向移动的是________
a.选用更高效的催化剂
b.升高温度
c.及时分离出二氧化碳
d.增加SO2的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com