
科目: 来源:上海市崇明中学2012届高三上学期期中考试化学试题 题型:022
有可逆反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173 K时平衡常数K=2.15.
FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173 K时平衡常数K=2.15.
(1)该反应的平衡常数表达式________,是________(填“吸热”或“放热”)反应.
(2)若该反应在体积恒定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体的平均相对分子质量如何变化(填“增大”、“减小”或“不变”).
①升高温度________;
②再通入CO________.
(3)该反应的逆反应速率随时间变化的关系如图:

①从图中可以看出,反应t2时达到平衡,在t1时改变某种条件,该条件可能是________.
A.升高温度
B.增大CO2浓度
C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新的平衡状态,请在图上画出t3~t5的v(逆)变化曲线.
查看答案和解析>>
科目: 来源:上海市崇明中学2012届高三上学期期中考试化学试题 题型:022
六价铬[Cr(Ⅵ)]有剧毒,废水中的Cr2O![]() 常用铁氧磁体法除去,即把过量的FeSO4·7H2O加入含Cr2O
常用铁氧磁体法除去,即把过量的FeSO4·7H2O加入含Cr2O![]() 的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+.
的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+.
(1)写出Fe2+还原Cr2O![]() 的离子方程式,并标明电子转移的方向和数目:
的离子方程式,并标明电子转移的方向和数目:
________.
(2)调节(1)得到溶液的pH值为8~10,将析出相当于Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4(磁性材料铁氧体)的沉淀,由(1)可确定x=________.
(3)Cr3+在过量的NaOH溶液中会转化为CrO![]() ,写出这一转化的离子方程式________,由此可知Cr(OH)3呈________(选填“酸”、“碱”或“两”)性.
,写出这一转化的离子方程式________,由此可知Cr(OH)3呈________(选填“酸”、“碱”或“两”)性.
查看答案和解析>>
科目: 来源:上海市崇明中学2012届高三上学期期中考试化学试题 题型:022
二十一世纪世界资源争夺的重点是海洋.海底有石油、可燃冰、石油气、矿砂、锰结核的资源,海水中除有渔业资源外,还有食盐、溴、碘等许多化学资源,所有资源中最丰富的是水资源.
(1)海水中质量分数最高的元素是氧,该元素的原子核外电子占据的轨道共有________个能级,有________个未成对电子.
(2)水的沸点为100℃,氟化氢的沸点为19.5℃,水与氟化氢比较,稳定性较强的是________.水的沸点比硫化氢高,其原因是________.
(3)提取碘是将海带灼烧成灰,溶于水过滤,滤液中通入氯气,反应的离子方程式为________,再用四氯化碳将生成的单质碘________(填写实验操作名称)出来,最后用________(填写实验操作名称)使碘和四氯化碳分离.
(4)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的最外层电子排布都可表示为________.
查看答案和解析>>
科目: 来源:上海市崇明中学2011-2012学年高二上学期期中考试化学试题 题型:022
(1)在下面元素周期表中画出金属元素与非金属元素的分界线.

(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的________族.
(3)甲、乙两种元素,甲元素原子核外第三电子层上有7个电子,乙元素的焰色反应呈黄色.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲元素与硫元素相比较,非金属性较强的是________(填名称),写出可以验证该结论的一个化学方程式:________.
查看答案和解析>>
科目: 来源:浙江省嘉兴市一中2010-2011学年高二3月月考化学试题 题型:022
(1)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液________mL(假定溶液体积有加和性,下同).
(2)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=________.
(3)将0.1 mol/L盐酸和0.06 mol/L氢氧化钡溶液等体积混合后,该混合溶液pH=________.
(4)25℃时,pH=a的10体积的某强酸与pH=b的1体积的某强碱混合后,溶液呈中性,则a和b满足的关系________.
查看答案和解析>>
科目: 来源:浙江省嘉兴市一中2010-2011学年高二3月月考化学试题 题型:022
已知:向一体积为2 L的密闭容器中加入0.1 mol碘单质和足量的钨,当温度为943 K时存在:W(s)+I2(g)![]() WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
(1)求943 K时此反应的平衡常数:K=________.
(2)若起始时向此密闭容器中再加入0.1 mol WI2达平衡,此时容器中各气体的体积比:________,当同时加入等物质的量I2(g)和WI2(g),平衡________方向移动(填正反应、逆反应或不移动)
(3)画出W(s)+I2(g)![]() WI2(g) ΔH<0时间-速率图.一定温度过量W反应达到平衡,到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
WI2(g) ΔH<0时间-速率图.一定温度过量W反应达到平衡,到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
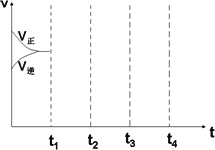
(4)一定温度下,向一容积不变的容器中加入足量钨和1 mol I2(g),使之反应:W(s)+I2(g)![]() WI2(g) ΔH=-40.9 KJ/mol,反应达平衡时气体平均摩尔质量增加91.9 g/mol,反应达平衡时放出的热量________.(已知钨的相对原子质量为183.8):
WI2(g) ΔH=-40.9 KJ/mol,反应达平衡时气体平均摩尔质量增加91.9 g/mol,反应达平衡时放出的热量________.(已知钨的相对原子质量为183.8):
查看答案和解析>>
科目: 来源:山东省潍坊市重点中学2011年新高一暑假作业(三)化学试题 题型:022
(1)衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难________而易________.有机化工厂附近严禁火种,这是因为绝大多数有机物________.
(2)芬必得是一种性能优良,使用广泛的解热、镇痛、抗炎症的长效缓释药物,其主要成分的结构简式如下图所示:观察结构填空或回答下列问题
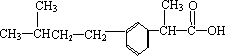
①它的分子式为________,
②请分别写出它和乙醇、小苏打溶液反应的化学方程式:________;________
查看答案和解析>>
科目: 来源:山东省潍坊市重点中学2011年新高一暑假作业(三)化学试题 题型:022
下图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
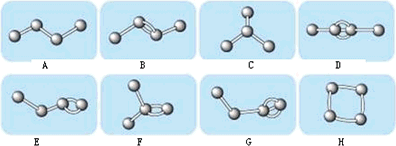
(1)图中属于烷烃的是________(填编号)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成________和________;不仅可以形成________,还可以形成碳环.
(3)上图中互为同分异构体的是:A与________;B与________;D与________.(填编号)
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2010-2011学年高二下学期期末考试化学试题 题型:022
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
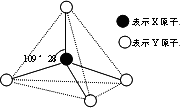
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式________;同主族的第四周期元素基态原子的外围电子排布式为________.
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序:________.
(3)上述六种物质或粒子中互为等电子体的是________(写出化学式).
(4)F分子的中心原子杂化类型是________,F易溶于E,其原因是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com