
科目: 来源:山西省山大附中2012届高三下学期2月第二次月考理综化学试题 题型:022
A~G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C的硫酸盐溶液通常为蓝色,它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去).

(1)写出G分子的结构式________.
(2)写出反应⑦的离子方程式________.
(3)写出电解X溶液的阳极反应式________.
(4)写出反应④的化学方程式________.
(5)若使F按下列途径完全转化为Y:
则参加反应的F与整个过程中消耗D的物质的量之比为________.
查看答案和解析>>
科目: 来源:山西省山大附中2012届高三下学期2月第二次月考理综化学试题 题型:022
能源在国民经济中具有特别重要的战略地位.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应b:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“a”或“b”).
②下表所列数据是反应b在不同温度下的化学平衡常数(K)
Ⅰ.由表中数据判断ΔH2________0(填“>”、“<”或“=”);
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是________
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
(2)环境问题已成为社会关注的焦点.某农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将CaO投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,则溶液中c(PO43-)=________(已知K sp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应式为Mg2+(aq)+NH4+(aq)+PO43-(aq)![]() MgNH4PO4(s),该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为________.
MgNH4PO4(s),该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为________.
查看答案和解析>>
科目: 来源:山东省诸城一中2012届高三下学期阶段测试化学试题 题型:022
置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):

请回答下列问题:
(1)若单质甲与化合物A发生的反应常用于野外焊接钢轨,则该反应的化学方程式为________;
(2)若甲、乙分别是同主族的两种非金属固体单质,则化合物A的一种主要用途是________;
(3)若甲、乙分别是同主族短周期元素的两种单质,化合物B是一种强碱,则反应的离子方程式为________;
(4)若组成单质乙的元素的最外层电子数是次外层电子数的2倍,金属单质甲能在化合物A中燃烧,则该反应中氧化剂与还原剂的物质的量之比为________;若反应中生成2.4 g单质乙,则消耗的化合物A在标准状况下的体积为________.
查看答案和解析>>
科目: 来源:山东省诸城一中2012届高三下学期阶段测试化学试题 题型:022
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.
(1)现有以下5种物质:SO2、SiO2、CaO、Fe2O3、Na2O2、Al2O3.按照不同的分类标准,它们中有一种物质与其它物质有明显的不同,请找出这种物质并写出依据(试写出任意一种合理的分类方法):________.
(2)从上述物质中分别找出两种能相互反应的物质,试写出符合下列条件的方程式各一个:
①属于氧化还原反应________,
②属于非氧化还原反应________.
查看答案和解析>>
科目: 来源:山东省诸城一中2012届高三下学期阶段测试化学试题 题型:022
水是生命之源,也是化学反应中的主角.试回答下列问题:
(1)写出水分子的结构式________.
(2)全部由短周期元素组成的A、B、C三种物质,是中学化学常见的有色物质,它们均能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂.请写出A、B、C与水反应的化学方程式:
①A+H2O________;
②B+H2O________;
③C+H2O________.
查看答案和解析>>
科目: 来源:安徽省宣城中学2011-2012学年高二3月月考化学试题 题型:022
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
(1)已知:2NO2(g)![]() N2O4(g) ΔH=-57.20 kJ·mol-1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g) ΔH=-57.20 kJ·mol-1.一定温度下,在密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是________(填字母).
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是________(填字母).
A.减小NO2的浓度
B.降低温度
C.增加NO2的浓度
D.升高温度
(2)25℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量.则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的ΔH=________kJ·mol-1.
(3)17℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1.则此温度下平衡常数K=________
查看答案和解析>>
科目: 来源:安徽省宣城中学2011-2012学年高二3月月考化学试题 题型:022
人们对苯及芳香烃的认识有一个不断深化的过程.
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个叁键且无支链链烃的结构简式________.
(2)已知分子式为C6H6的结构有多种,其中的两种为
①这两种结构的区别表现在:定性方面(即化学性质方面):Ⅱ能________(选填a、b、c、d,多选扣分)而Ⅰ不能
a、被酸性高锰酸钾溶液氧化
b、能与溴水发生加成反应,
c、能与溴发生取代反应
d、能与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时:Ⅰ需________mol,而Ⅱ需________mol.
②今发现C6H6还可能有另一种如下图立体结构:该结构的二氯代物有________种.

(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断,它的结构简式可能是下列中的________(填入编号)
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目: 来源:安徽省宣城中学2011-2012学年高二3月月考化学试题 题型:022
命名或写出结构简式:
(1)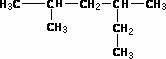 ________
________
(2)![]() ________
________
(3) ________
________
(4)间甲基苯乙炔________
(5)反-2-戊烯________
查看答案和解析>>
科目: 来源:上海市十校2012届高三第二次联考化学试题 题型:022
由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率.根据下面金丝桃素的结构简式回答下列问题:
1、金丝桃素能在NaOH水溶液中加热反应得A和B,B为芳香族化合物,写出B的结构简式:B:________,A的分子式是________
2、室温下,B用稀盐酸酸化得C,下列物质中不能和C发生反应的是________(填序号)
①浓H2SO4和HNO3的混合
②H2(催化剂加热)
③CH3CH2CH2CH3
④Na
⑤O2(催化剂)
⑥NaHCO3溶液
3、写出两分子C与浓H2SO4共热,生成八元环状物的化学方程式:
________.
4、写出符合下列条件的与C互为同分异构体是________.(任写一种)
①能发生银镜反应②苯环上的一卤代物有3种③1 mol该有机物与足量金属钠反应产生1 mol气体
查看答案和解析>>
科目: 来源:上海市十校2012届高三第二次联考化学试题 题型:022
三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业.下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”:

已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;
②三聚氰胺的熔点是354℃,加热易升华,微溶于水;
③以尿素为原料生产三聚氰胺的原理是:6CO(NH2)2![]() C3N6H6+6NH3+ 3CO2
C3N6H6+6NH3+ 3CO2
请回答:
1、尿素是一种常用含氮量最高的化肥,其氮元素的质量百分数为________,在实验室使其熔化的容器名称叫________.
2、工业上合成尿素的化学反应方程式为________(反应条件可以不写)
3、写出各主要成份的化学式:产品1________、产品2________、X________;4、联氨系统沉淀池中发生的化学反应方程式为:________;
5、为了使母液中析出更多的产品2,常用的方法是________
A.加入固体NaCl
B.加入固体NaHCO3
C.通入CO2气体
D.通入NH3
6、若生产过程中有4%的尿素损耗,每吨尿素可生产三聚氰胺________吨,副产品纯碱________吨.(精确到0.001)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com