
科目: 来源:广东省梅县东山中学2011-2012学年高二上学期期中考试化学试题 题型:022
已知可逆反应:M(g)+N(g)![]() p(g)+Q(g),ΔH>0,在一密闭容器中进行.
p(g)+Q(g),ΔH>0,在一密闭容器中进行.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时,求算该反应平衡常数K=________,N的转化率为________.
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”);
(3)若反应温度不变,保持容器体积不变,反应物的起始浓度分别为:c(M)=2 mol/L,c(N)=________mol/L;C(P)=2 mol/L,C(Q)=________mol/L,达到平衡后,各物质的百分含量与原平衡相同.
查看答案和解析>>
科目: 来源:广东省梅县东山中学2011-2012学年高二上学期期中考试化学试题 题型:022
(1)写出下列物质的电离方程式.
H2CO3:________,NH4HSO4:________.
(2)有相同体积物质的量浓度都是1.0 mol·L-1的硫酸、盐酸和醋酸三种溶液,设它们的pH值分别为a,b,c.按由大到小的顺序排列:________.
(3)将质量相同的铁粉分别放入pH值相同的三杯溶液中,它们分别为硫酸,醋酸,盐酸.刚开始时三者的速率分别记为v1,v2,v3,则三者大小关系为:________.若三种酸溶液的量都足量,铁粉在三种溶液中溶解所消耗的时间分别记为t1,t2,t3.则三者之间的大小关系为:________.
(4)电离常数K表示电解质电离的能力,K愈小,表示电离程度愈________(填大或小).K随温度升高而________(填增大或减小),原因是:________.
查看答案和解析>>
科目: 来源:河北省正定中学2011-2012学年高二上学期期中考试化学试题 题型:022
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变).

t1:增大NO的浓度
t2:降低温度
(4)判断该条件下反应能否自发.________
查看答案和解析>>
科目: 来源:河北省正定中学2011-2012学年高二上学期期中考试化学试题 题型:022
常温下,将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1 L混合溶液,
(1)该溶液中存在的三个平衡体系是________、________、________.(用方程式表示)
(2)溶液中共有________种不同的粒子.
(3)这些粒子中浓度为0.01 mol/L的是________,浓度为0.002 mol/L的是________.
(4)物质的量之和为0.01 mol的两种粒子是________和________.
(5)________和________两种粒子数量之和比OH-多0.008 mol
查看答案和解析>>
科目: 来源:河北省正定中学2011-2012学年高二上学期期中考试化学试题 题型:022
某盐或“类盐”的化学式为XmYn最简结构,将一定量的该盐溶于足量的水时:
(1)若m≠n,测得溶液的pH为5,若该盐只存在一种能水解的离子,则该离子与水反应的离子方程式为________.
(2)若m≠n,测得该盐溶液的pH为9,若该盐只存在一种能水解的离子,则该盐与水反应的离子方程式为________.
查看答案和解析>>
科目: 来源:河北省正定中学2011-2012学年高二上学期期中考试化学试题 题型:022
25℃时,①氢氟酸 ②醋酸 ③次氯酸的电离常数分别是3.5×10-4、1.8×10-5、3.0×10-8.请推测:
(1)它们的酸性由强到弱的顺序为________(填序号,下同),
(2)相同浓度的溶液中,氢离子浓度最大的是________,电离程度最小的是________;
(3)相同浓度的④氟化钠溶液、⑤醋酸钠溶液、⑥次氯酸钠溶液pH的从大到小顺序:________
查看答案和解析>>
科目: 来源:江西省上高二中2011-2012学年高二第一次月考化学试题(实验班) 题型:022
aA(g)+bB(g)![]() cC(g)+dD(g)反应达到平衡时,瞬时速率
cC(g)+dD(g)反应达到平衡时,瞬时速率![]() 为速率常数),又
为速率常数),又![]() 为化学平衡常数).在2L体系中加入4 mol SO2和2 mol O2且500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
为化学平衡常数).在2L体系中加入4 mol SO2和2 mol O2且500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
(1)起始时正反应速率是平衡时的_________倍.
(2)在500℃时该反应的平衡常数k2是_________.
(3)在温度不变时再向平衡体系中加入2 mol SO2、2 mol O2和4 mol SO3,平衡将向_________移动.
查看答案和解析>>
科目: 来源:江西省上高二中2011-2012学年高二第一次月考化学试题(实验班) 题型:022
依据事实,写出下列反应的热化学方程式.
(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ.则表示甲醇燃烧热的热化学方程式为:_________.
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量_________.
(3)已知拆开1 mol H-H键,1 mol N-H键,1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为:_________.
查看答案和解析>>
科目: 来源:新人教版2011-2012学年高二上学期单元测试(2)化学试题 题型:022
2003年10月15日,我国成功发射“神舟五号”载人飞船.这标志着我国在航天领域的重大突破:
(1)肼(N2H4)是发射航天飞船常用的高能燃料.一般将液太N2O4作为火箭的推进剂.已知1 mol液态肼与足量液态N2O4完全反应放出Q kJ的热量,产物是对环境无害的氮气和水蒸气.写出该反应的热化学方程式________.但实际发射过程中会看到有大量红色的烟雾,除了该反应可能产生少量NO外,产生此现象的原因可能是________.
(2)实际上,最理想的燃烧热大,体积小,本身毒性小.安全的固态氢,目前人们还不能制得固态氢,因为________.
(3)新型无机材料在航天工业中也有广泛应用.如飞船表面覆盖有一种耐高温的氮化硅陶瓷,该物质中各原子均满足最外层8电子结构,则氮化硅的化学式为________.
(4)飞船上的能量主要来自于太阳能和燃料电池.常用的燃料电池是氢氧燃料电池,已知负极的反应式为:2H2-4e-+4OH-![]() 4H2O,正极的反应式为________.
4H2O,正极的反应式为________.
查看答案和解析>>
科目: 来源:河北省存瑞中学2010-2011学年高二下学期第二次月考化学试题 题型:022
依据氧化还原反应:2Ag+(aq)+Cu(s)![]() Cu2+(aq)+2Ag(s)设计的原电池如图所示.
Cu2+(aq)+2Ag(s)设计的原电池如图所示.
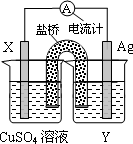
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________;
(2)银电极发生的电极反应为________;
X电极上发生的电极反应为________;
(3)外电路中的的电子式从________电极流向________电极.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com