
科目: 来源:山东省济宁市金乡二中2011-2012学年高一下学期期中考试化学试题 题型:022
控制变量法是研究化学变化量的重要思想方法.请仔细观察下表中50 mL稀盐酸和1 g碳酸钙反应的实验数据:

(1)该反应属于________反应(填“吸热”或“放热”).
(2)实验5、6表明________对反应速率的影响,说明________,反应速率越快.
(3)根据实验1、3、5可以得出条件对反应速率的影响规律是________.
(4)从本实验数据中分析,影响化学反应速率的因素还有________,能表明这
一规律的实验序号是________.
查看答案和解析>>
科目: 来源:山东省济宁市金乡二中2011-2012学年高一下学期期中考试化学试题 题型:022
如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分.

(1)其中代表金刚石的是(填编号字母,下同)________,金刚石属于________晶体.
(2)其中代表石墨的是________,其晶体中碳原子呈平面________结构排列.
(3)其中代表NaCl的是________,晶体中Na+与Cl-之间通过________键结合起来.
(4)代表干冰的是________,它属于________晶体,CO2分子间通过________结合起来.
(5)上述物质中前三种熔点由高到低的排列顺序为________.
查看答案和解析>>
科目: 来源:山东省济宁市金乡二中2011-2012学年高一下学期期中考试化学试题 题型:022
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2),并将Cl2依次通入NaBr溶液和KI-淀粉溶液中.如图所示仪器及药品,试回答:

(1)若所制取气体从左向右流向时,上述仪器接口的连接顺序为________接________、________接________、________接________、________接________.(填字母)
(2)实验开始后装置5中反应的离子方程式为________.
(3)装置3的作用是________,反应的离子方程式为________.
(4)装置1中产生的现象是:溶液先变蓝一段时间后蓝色褪去,生成两种强酸,请写出蓝色褪去的化学方程式:________.
查看答案和解析>>
科目: 来源:山东省济宁市金乡二中2011-2012学年高二下学期期中考试化学试题 题型:022
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体.该变化过程的离子反应方程式为________向这种液体中加入Mg(OH)2固体,产生的现象为________
(2)不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体可能是________(填化学式).
(3)在配制FeCl3溶液时,为防止浑浊,应加入________(填化学式).
(4)写出FeCl3溶液各离子浓度由大到小的顺序是________.
(5)常温下,PH=5的FeCl3溶液与PH=5的盐酸其中水电离的c(H+)之比为________.
查看答案和解析>>
科目: 来源:山东省济宁市金乡二中2011-2012学年高二下学期期中考试化学试题 题型:022
(1)键线式![]() 表示的分子式________;名称是________.
表示的分子式________;名称是________.
(2) 中含有的官能团的名称为________.
中含有的官能团的名称为________.
(3)用价层电子对互斥理论推测下列分子的空间构型:SO2________;HCHO________.
(4)重结晶的首要工作是选择适当的溶剂,要求该溶剂:
a.杂质在此溶剂中溶解度________.
b.被提纯的物质在此溶剂中溶解度________.
查看答案和解析>>
科目: 来源:山东省济宁市金乡二中2011-2012学年高二下学期期中考试化学试题 题型:022
某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL).回答下列问题:
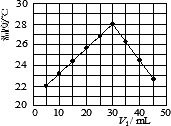
(1)研究小组做该实验时环境温度________(填“高于”、“低于”或“等于”)22℃.
(2)由题干及图形可知,V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为________mol/L.
(3)实验时将酸碱在简易量热计中混合,并用________搅拌,使溶液混合均匀.经有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式:________.
查看答案和解析>>
科目: 来源:山西省山大附中2011-2012学年高一下学期期中考试化学试题 题型:022
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________.
查看答案和解析>>
科目: 来源:山西省山大附中2011-2012学年高一下学期期中考试化学试题 题型:022
阅读下面的信息,推断元素及有关物质,按要求回答:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2.
(1)根据信息①,X一定不是________(填序号).
A.氢
B.碳
C.氧
D.硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,所生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26.
(2)这四种元素中是否可能有一种是铝元素?________(填可能或不可能).
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀.
(3)该白色沉淀物的化学式为________.
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀.
(4)生成该白色沉淀物的离子方程式为________.
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为________.
查看答案和解析>>
科目: 来源:山西省山大附中2011-2012学年高一下学期期中考试化学试题 题型:022
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4;1 mol A的单质跟足量盐酸反应,可置换出标准状况下22.4 L的H2,这时A转变为与氖原子具有相同电子层结构的离子.请回答:
(1)用电子式表示A和C组成的化合物的形成过程为________;
(2)B离子的电子式是________,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是________;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是________,(填氢化物化学式),原因是________;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本题涉及的含C元素的物质均易溶于水):________.
查看答案和解析>>
科目: 来源:黑龙江省哈师大附中2011-2012学年高二下学期第一次月考月考化学试题 题型:022
根据下列有机物的合成路线回答问题:
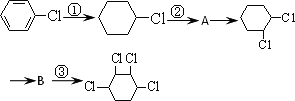
(1)写出A、B的结构简式:A________、B________.
(2)写出反应类型:①________、②________
(3)写出②、③的反应方程式:
②________,
③________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com