
科目: 来源:广西桂林市第十八中学2011-2012学年高二下学期期中考试化学理科试题 题型:022
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是________.

查看答案和解析>>
科目: 来源:重庆市西南大学附属中学2011-2012学年高二下学期期中考试化学试题 题型:022
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素.
回答下列有关问题:
(1)W原子的价电子排布图为________.
(2)化合物Q2W2的电子式________,化合物XYZ的结构式________.
(3)Y、Z、W分别与X形成常见化合物的沸点由高到低的顺序是________(用分子式表示).
(4)RW3分子中的键角________,W3分子的立体构型是________形.
(5)根据等电子原理,指出与YW2互为等电子体且含有Z原子的微粒有________、________.(要求写一种分子和一种离子).
查看答案和解析>>
科目: 来源:重庆市西南大学附属中学2011-2012学年高二下学期期中考试化学试题 题型:022
回答下列问题
(1)CH4、CO2、COCl2和![]() 四种分子中,碳原子为 sp2杂化的分子是________.
四种分子中,碳原子为 sp2杂化的分子是________.
(2)NH3分子的立体构型是________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式________.
(3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________.
(4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g),若该反应中有4 mol N-H键断裂,则形成σ键有________mol和形成π键有________mol.
(5)H2O熔沸点都比H2S高,其原因是________.
查看答案和解析>>
科目: 来源:河北省冀州中学2011-2012学年高一下学期期中考试化学理科试题(A)卷科 题型:022
合成氨对化学工业和国防工业具有重要意义.
(1)写出工业上合成氨的化学方程式________.
(2)下图为不同温度时平衡混合物中氨的体积分数分别与时间(t)和压强(P)的关系.

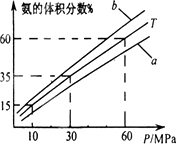
其中T=500℃,温度为450℃对应的曲线是________(选“a”或“b”).
(3)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
一定温度下,在2 L容器中发生上述反应,各物质的投料及物质的量变化如下表:

①析表中数据,判断5-7 min之间反应是否处于平衡状态________(填“是”或“否”),前5 min平均反应速率v(CH4)=________.
②反应在7~10 min之间,CO的物质的量减少的原因可能是________(填字母).
a.减少CH4
b.降低温度
c.增大压强
d.充入H2
③若保持温度不变,向1 L容器中充入0.15 mol CH4、0.45 mol H2O、________mol CO、________mol H2,达到平衡时CH4的体积分数与第一次投料相同.
查看答案和解析>>
科目: 来源:河北省冀州中学2011-2012学年高一下学期期中考试化学理科试题(A)卷科 题型:022
A、B、C、D、E、F为原子序数依次增大的六种短周期元素,其中仅含一种金属元素.A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B元素的气态氢化物与其最高价氧化物的水化物化合生成一种盐,B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙).请回答下列问题:
(1)F的元素名称________,D元素在周期表中位置________,乙的电子式为________,甲的结构式________.
(2)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,所产生的气体可充填气球,请写出该反应的离子方程式________.
(3)A与C、A与E均可形成18电子分子,这两种分子在水溶液中反应有淡黄色沉淀生成,写出该反应的化学方程式________.
(4)均由A、C、D、E四种元素组成的两种化合物,在溶液中反应产生气体的离子方程式________.
(5)用化学方程式表示E.F的非金属性强弱________.
查看答案和解析>>
科目: 来源:河北省冀州中学2011-2012学年高一下学期期中考试化学理科试题(A)卷科 题型:022
已知1 mol SO2(g)完全转化为1 mol SO3(g)放热99 kJ.2SO2(g)+O2(g)![]() 2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:
2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:

(1)图中ΔH=________.
(2)该反应常用V2O5作催化剂,加入V2O5会使图中Ea________ΔH________(两空均填“升高”、“降低”或“不变”).
(3)已知单质硫的燃烧热为296 kJ·mol-1,写出反应的热化学方程式:________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为________.
查看答案和解析>>
科目: 来源:河北省冀州中学2011-2012学年高一下学期期中考试化学理科试题(B)卷科 题型:022
合成氨对化学工业和国防工业具有重要意义.
(1)写出工业上合成氨的化学方程式________.
(2)下图为不同温度时平衡混合物中氨的体积分数分别与时间(t)和压强(P)的关系.

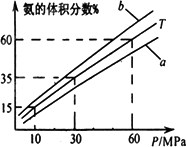
其中T=500℃,温度为450℃对应的曲线是________(选“a”或“b”).
(3)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
一定温度下,在2 L容器中发生上述反应,各物质的投料及物质的量变化如下表:
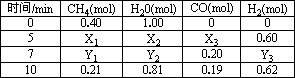
①析表中数据,判断5-7 min之间反应是否处于平衡状态________(填“是”或“否”),前5 min平均反应速率v(CH4)=________.
②反应在7~10 min之间,CO的物质的量减少的原因可能是________(填字母).
a.减少CH4
b.降低温度
c.增大压强
d.充入H2
③若保持温度不变,向1 L容器中充入0.15 mol CH4、0.45 mol H2O、________mol CO、________mol H2,达到平衡时CH4的体积分数与第一次投料相同.
查看答案和解析>>
科目: 来源:河北省冀州中学2011-2012学年高一下学期期中考试化学理科试题(B)卷科 题型:022
已知1 mol SO2(g)完全转化为1 mol SO3(g)放热99 kJ.2SO2(g)+O2(g)![]() 2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:
2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:

(1)图中ΔH=________.
(2)该反应常用V2O5作催化剂,加入V2O5会使图中Ea________ΔH________(两空均填“升高”.“降低”或“不变”).
(3)已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为________.
查看答案和解析>>
科目: 来源:浙江省金华一中2011-2012学年高一下学期期中考试化学试卷 题型:022
(1)某温度下,在一密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示.分析有关数据,写出X、Y、Z反应的化学方程式________.
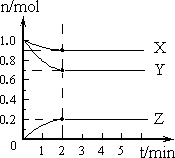
(2)某温度下,在另一密闭容器中充入2 mol X和3 mol Y,然后按(1)中的化学方程式进行反应,当达到化学平衡时,测得Z的物质的量分数为25%,求平衡时X的转化率.
查看答案和解析>>
科目: 来源:福建师大附中2011-2012学年高一下学期期中考试化学试题 题型:022
在一定温度下,在容积为2 L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:

(1)若t1=5 S,则前5S用M表示的反应速率为________.
(2)t2时,正反应速率________(填“大于”“等于”或“小于”)逆反应速率.
(3)下列说法正确的是________.
A.t2时刻该反应达到平衡
B.t3时刻该反应达到平衡
C.反应开始时,生成物的浓度为0
D.该反应的限度是可以改变的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com