
科目: 来源:江苏省射阳中学2011-2012学年高一下学期期中考试化学试题 题型:022
下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
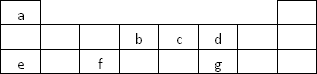
(1)f元素在周期表中的位置是________.
(2)b元素形成的同素异形体的晶体类型可能是(填序号)________.
①原子晶体
②离子晶体
③分子晶体
④金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为________.
(4)化合物ca3在催化剂(如铂等)、加热的条件下能发生催化氧化,此反应是工业制硝酸的基础.化学方程式为________,若有1.25 mol电子发生转移,则参加反应的ca3的体积为________L(标准状况).
(5)a、c、d中的两种元素可组成多种具有10电子的分子和离子,写出其中两种离子反应生成两种分子的离子方程式________.
(6)由a、b、c、d四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为________.
查看答案和解析>>
科目: 来源:江苏省射阳中学2011-2012学年高一下学期期中考试化学试题 题型:022
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.

(1)阴影部分元素在元素周期表中的位置为________族.
(2)根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4.(用“>”、“<”或“=”表示)
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,试写出其完全燃烧的方程式________.
(4)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度________(选填“更大”、“更小”或“相同”).
(5)试比较S、O、F三种元素的原子半径大小:________>________>________(填元素符号).
(6)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.写出羰基硫分子的电子式________.
查看答案和解析>>
科目: 来源:江苏省射阳中学2011-2012学年高一下学期期中考试化学试题 题型:022
氯化铵是一种重要的化工原料,应用广泛.
(1)实验室通常用NH4Cl固体与Ca(OH)2固体混合共热制取氨气.
①写出实验室制取氨气的反应方程式________.
②浓氨水可以用来检验有毒气体氯气的泄漏,反应式为3Cl2+8NH3=N2+6NH4Cl,在该反应中,氧化剂是________(填化学式),检测时观察到的现象是________,21.3 g氯气能氧化氨气________mol.
(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是________(填字母).
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
A.①②
B.③④
C.①③
D.②④
查看答案和解析>>
科目: 来源:江苏省射阳中学2011-2012学年高二下学期期末考试化学试题 题型:022
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备NF3的化学反应方程式:________.
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是________.
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为:________.
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含三种元素,则其中心原子是________,配位数为________.
查看答案和解析>>
科目: 来源:江西省南城一中2011-2012学年高二12月月考化学试题 题型:022
(1)在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是________.(用a、b、c表示,)
(2)取10 mL的某物质量浓度的醋酸溶液,通入等物质的量的氨气后,溶液的导电性质________(填“增强”“减弱”或“不变”);另取10 mL的该溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”、“减小”或“无法确定”).
的比值将________(填“增大”、“减小”或“无法确定”).
(3)在一定量某物质量浓度的醋酸溶液,加入下列物质能使CH3COO-浓度增大而H+浓度减小的物质是________.
A、烧碱固体
B、铜
C、冰醋酸
D、醋酸钠固体
E、氧化镁
F、水
查看答案和解析>>
科目: 来源:江西省南城一中2011-2012学年高二12月月考化学试题 题型:022
(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是:________.
(2)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,若1 g水蒸气转化成液态水时放热2.444 KJ,试写出氢气燃烧热的热化学方程式________.
查看答案和解析>>
科目: 来源:浙江省宁波市八校2011-2012学年高二下学期期末联考化学试题 题型:022
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用________作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是________.
(2)下图表示50 mL滴定管中液面的位置,若A与C刻度间相差1 mL,C处的刻度为26,滴定管中液面读数应为mL,此时滴定管中液体的体积________mL.

(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,三次实验结果记录如下:
![]()
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是________.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
C=________.
查看答案和解析>>
科目: 来源:浙江省宁波市八校2011-2012学年高二下学期期末联考化学试题 题型:022
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________.(填字母)
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) ΔH<0
C.2CO(g)+O2(g)=2CO2(1) ΔH<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为________.
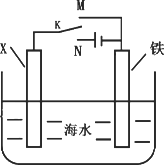
(3)利用下图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于________处,此时溶液中的阴离子向极(填X或铁)移动.
查看答案和解析>>
科目: 来源:湖南省衡阳七校2011-2012学年高一上学期期末质量检测化学试题 题型:022
将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96 L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72 L.
(1)写出与碱反应涉及的化学方程式:________.
(2)混合物中Al和Fe的质量分别为________和________.(写出必要计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com