
科目: 来源: 题型:022
某有机物A含C
54.8%,H 5.58%,N 7.11%,其余含O,A的相对分子质量不超过300.A是a-氨基酸,分子中不存在甲基(![]() ),能与
),能与![]() 溶液发生显色反应,1 molA最多能与3molNaOH完全反应.
溶液发生显色反应,1 molA最多能与3molNaOH完全反应.
请回答:
(1)有机物A的相对分子质量为________,其分子式为____________.
(2)符合上述条件的有机物A的可能结构有________(填数字)种,写出其中的任一种的结构简式____________________.
查看答案和解析>>
科目: 来源: 题型:022
自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景.合成芳炔类大环的一种方法是以苯乙炔(![]() )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
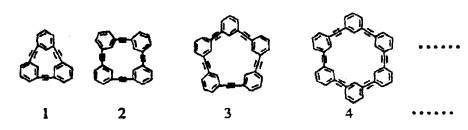
(1)上述系列中第1种物质的分子式为________.
(2)已知上述系列第1至第4种物质的分子直径在1~100nm之间,分另将它们溶解于有机溶剂中,形成的分散系为________.
(3)以苯乙炔为基本原料,经过一定反应而得到最终产物.假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为________.
(4)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(![]() )为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:022
在沥青蒸气里含有多种稠环芳香烃,其中一些可视为同系物,如A、B、C……所示,它们都含有偶数个苯环结构.填空:
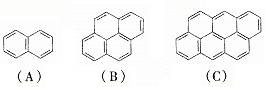
(1)该系列化合物中相邻两种化合物间递增的![]() 值中的m和n的数值分别为:m=________,n=________.
值中的m和n的数值分别为:m=________,n=________.
(2)该系列化合物里碳的最大百分含量是________.
(3)又知A与等物质的量氢气加成产物有6种,其中的4种为:
![]()
另外两种为:________;________
查看答案和解析>>
科目: 来源: 题型:022
下列实验操作中,不正确的是________.
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
B.制氢氧化亚铁要向盛硫酸亚铁溶液的试管中用滴管竖直于试管口外滴入试管中
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.配制0.5 mol·L-1的氯化钠溶液时,溶解食盐用的烧杯洗后将洗液倒掉
E.称量氢氧化钠固体不能直接放到托盘上,托盘要垫纸
查看答案和解析>>
科目: 来源: 题型:022
磷是存在于自然界和生物体内的重要元素,回答下列与磷及其化合物有关的问题.
(1)磷在自然界里主要以____________的形式存在于矿石中.磷的单质有多种同素异形体,其中最常见的是有毒的____________无毒的____________.
(2)磷在不充足的氯气中燃烧的化学方程式为:____________.
而在过量的氯气中燃烧的化学方程式则是:____________.
(3)磷(相对原子质量为31)在空气中燃烧生成的氧化物通常可用做强干燥剂.制备100g这种干燥剂所消耗的空气的体积约为____________L(在标准状况下).
(4)有机磷农药“乐果”的结构简式是
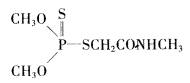 .其中所含的双键有________个.
.其中所含的双键有________个.
查看答案和解析>>
科目: 来源: 题型:022
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域.其制取原理为:![]() 由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质.为测定该产品中有关成分的含量,进行了以下两个实验:
由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质.为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00
g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成![]() ,并放出氨气3.36L(标准状况)
,并放出氨气3.36L(标准状况)
①上述反应的化学方程式为____________________________________.
②该样品中的AlN的质量分数为________.
(2)另取10.00
g样品置于反应器中,通入2.016L(标准状况)![]() ,在高温下充分反应后测得气体的密度为1.34g·
,在高温下充分反应后测得气体的密度为1.34g·![]() (已折算成标准状况,AlN不跟
(已折算成标准状况,AlN不跟![]() 反应).该样品中含杂质炭________g.
反应).该样品中含杂质炭________g.
查看答案和解析>>
科目: 来源: 题型:022
在25℃,101KPa条件下,将![]() 通入10L CO和
通入10L CO和![]() 的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
(1)若剩余气体的体积是15L,则原CO和![]() 的混合气体中V(CO)=________L,
的混合气体中V(CO)=________L,![]() ________L。
________L。
(2)若剩余气体的体积是aL,则原CO和![]() 的混合气体中V(CO)∶
的混合气体中V(CO)∶![]() =________;
=________;
(3)若剩余气体的体积是aL,则a的取值范围是________.
查看答案和解析>>
科目: 来源: 题型:022
实验表明,液态时,纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也强于纯水.又知液态电解质都有能像水那样自身电离而建立电离平衡(即像![]()
![]()
![]() 一样),且在一定温度下都有各自的离子积常数.由此回答:
一样),且在一定温度下都有各自的离子积常数.由此回答:
(1)纯硫酸在液态时自身电离的电离反应是________,它在25℃时的离子积常数![]() 比1×
比1×![]() ________(填大或小,或相等).
________(填大或小,或相等).
(2)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是________,这是因为混合液中不仅存在两种电离平衡(即![]() 和
和![]() 各自的电离反应)而且还因
各自的电离反应)而且还因![]() 的酸性强于
的酸性强于![]() ,又在无水条件下,混合酸中必发生(写离子反应式)________反应而造成的.故
,又在无水条件下,混合酸中必发生(写离子反应式)________反应而造成的.故![]() 与
与![]() 的无水混合酸中存在的化学平衡为________.
的无水混合酸中存在的化学平衡为________.
(3)由于硫酸(或浓![]() )的强烈吸水性,所以在
)的强烈吸水性,所以在![]() 与
与![]() 混合酸中还存在一种较为简单的含氮的阳离子,它是________.
混合酸中还存在一种较为简单的含氮的阳离子,它是________.
查看答案和解析>>
科目: 来源: 题型:022
现代生活中,人们越来越注意微量元素的摄入.碘元素对人体健康有着至关重要的作用.为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40-50mg碘酸钾.
回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒.请简述其中所包含的化学原理________.
(2)![]() 可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
![]() ,则两极的电极反应式分别为:阴极________;阳极________.
,则两极的电极反应式分别为:阴极________;阳极________.
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为________.为进一步确定该样品是否为合格产品,该生又用0.030 mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:![]() ),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
查看答案和解析>>
科目: 来源: 题型:022
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始时,VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X+Y![]() 3Z+Q (X、Y、Z均为气体),达到平衡时,VA=1.2aL。试回答:
3Z+Q (X、Y、Z均为气体),达到平衡时,VA=1.2aL。试回答:
(1)A中X的转化率aA=________;
(2)A、B中x转化率的关系:aA=________aB(填“>”、“=”、“<” );
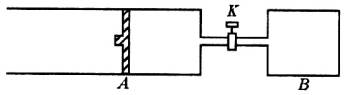
(3)打开K,一段时间又达平衡时,A的体积为________L(连通管中气体体积不计);
(4)在(3)达平衡后,同时等幅升高A、B的温度,达新平衡后,A的体积________(填“变大”、 “不变”、 “变小”),其理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com