
科目: 来源: 题型:022
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的溶液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:

(1)混合物中NaOH的质量是________g,AlCl3的质量是________g,MgCl2的质量是________g。
(2)P点所表示盐酸加入体积为________mL。
查看答案和解析>>
科目: 来源: 题型:022
今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室制备一定量的氢氧化铝。可分别采用如下化学方程式所表示的两种方法:
①2Al+3H2SO4=Al2(SO4)3+3H2↑; Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
②2Al+2NaOH+2H2O=2NaAlO2+3H2↑; 2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4
(1)上述哪一种方法比较节约试剂?(提示:试从每生产2mol Al(OH)3所耗费的试剂用量予以说明。)
(2)原料相同,请设计一种更为节约试剂的方法(以方程式表示,并说明其可以最节约试剂的根据)。
查看答案和解析>>
科目: 来源: 题型:022
在m mLbmol/L的AlCl3溶液中加入等体积amol/L的NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的是________mol。
(2)当a、b满足________条件时,无沉淀生成。
(3)当a、b分别满足________、________条件时,有沉淀生成,生成Al(OH)3沉淀的物质的质量分别是________和________。
查看答案和解析>>
科目: 来源: 题型:022
某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。其实验步骤如下:将土样和纯碱混匀,加热熔融,冷却后用水浸取熔块,过滤,弃去残渣。滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即为净水剂。
(1)熔融时主要成分与纯碱的反应方程式(Al2O3与纯碱反应和SiO2与纯碱反应相似)为________、________。
(2)最后沉淀物是________,生成该沉淀的离子方程式为________。
(3)净水剂的净水原理是________。
(4)实验室中常用的坩埚有瓷坩埚、铁坩埚和刚玉坩埚,本实验在熔融土样时应选用________坩埚。
查看答案和解析>>
科目: 来源: 题型:022
工业上用铝土矿(主要成分是Al2O3·H2O、Al2O3·3H2O以及少量Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取的操作过程可用以下流程图表示: 
(1)写出滤液A中一种溶质与过量NaOH溶液反应进入滤液B中的离子方程式。
(2)若步骤①中没有过滤操作而直接进入步骤②,对后面操作将产生什么影响?
查看答案和解析>>
科目: 来源: 题型:022
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如下图所示。请填空回答:

(1)H2SO4溶液的物质的量浓度为________;
(2)若a=2.3,用于沉淀Fe3+,消耗NaOH的体积是________mL,铝土矿中各组成成分的质量分数ω,Al2O3为________,Fe2O3为________,SiO2为________;
(3)a值的范围应是________,在这个范围内,a值越大,________的质量分数越小。
查看答案和解析>>
科目: 来源: 题型:022
某无色溶液A可能由氯化镁、硫酸铝、硫氢化钾、硝酸钠、氢氧化钾中的一种或几种混合而成。在A溶液中逐渐加入稀硝酸,先产生白色沉淀,而后白色沉淀又会溶解,得无色溶液B。试回答以下问题:
(1)该无色溶液A所含溶质是上述物质中的________(写化学式),若不止一种物质,则其可能发生反应的离子方程式是________。
(2)上述无色溶液A和无色溶液B混合,写出有关离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:022
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示。可推知溶液甲含有的离子是_______,它们的物质的量浓度之比为_______,所加的淡黄色固体是(化学式)_______。

查看答案和解析>>
科目: 来源: 题型:022
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+ S2-、
AlO![]() 、、CO
、、CO![]() 、SO
、SO![]() 、SO
、SO![]() 。现取该溶液进行有关实验,实验结果如下所示
。现取该溶液进行有关实验,实验结果如下所示

(1)沉淀甲是________,生成沉淀甲的离子方程式为________。
(2)沉淀乙是________,由溶液甲生成沉淀乙的离子方程式为________。
(3)沉淀丙是________,如何用一化学实验来确定其成分?答:________。
(4)气体甲成分有哪几种可能?答:________。
(5)综合上述信息,可以肯定存在的离子有________。
查看答案和解析>>
科目: 来源: 题型:022
β—羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图。每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(-CH2CH2COOH),各片层间存在相互作用,连结成三维网状结构。
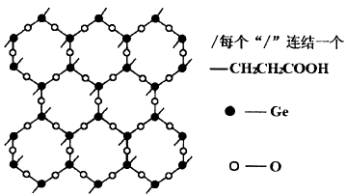
(1)每个正六边形平均拥有________个锗原子,________个氧原子。
(2)试写出Ge-132的化学式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com