
科目: 来源:物理教研室 题型:022
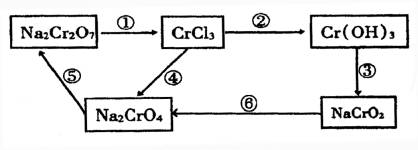
(1)上述各步骤中,需用还原剂的是________需用氧化剂的是________.(两空均填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是________(填化学式).它与NaOH溶液反应的离子方程式是____________________.
(3)配平下列化学方程式,并标出电子转移的方向和数目:
□![]() +□
+□![]() +□
+□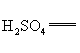 □
□![]() +□
+□![]() +□
+□![]() +□________
+□________
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)说明![]() 有氧化性,应选用的试剂是________(填数字序号),现象是___________
有氧化性,应选用的试剂是________(填数字序号),现象是___________
________,反应的离子方程式是______________________________________.
(2)说明![]() 有还原性,应选用的试剂是________(填数字序号),现象是___________
有还原性,应选用的试剂是________(填数字序号),现象是___________
______________,反应的离子方程式是________________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)该气体的组成是______________,气体混合物的物质的量比为______________.
(2)写出氯酸分解方程式并配平:__________________________,该反应的还原产物是______________(写化学式).
(3)结合化学反应方程式解释,该气体使润湿的淀粉—碘化钾试纸变蓝后又褪色的原因:__________________________________________________________________________
______________________________________________________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)配平溶液中所发生反应的化学方程式为:
□![]() +□
+□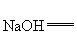 □NaCl+□
□NaCl+□![]() +□NaClO+□
+□NaClO+□![]()
(2)反应中的氧化剂是________,氧化产物为____________.
(3)此反应的离子方程式为________________________________________.
(4)每生成1mol NaClO,反应中转移的电子总数是________mol,若溶液的体积正好为100mL,则溶液中NaCl的物质的量浓度为________mol/L.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)实验室制备![]() 的方法是用亚氯酸钠与氯气反应:
的方法是用亚氯酸钠与氯气反应:
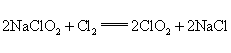 ,反应中的氧化产物是
,反应中的氧化产物是
(2)工业制备![]() 的一种方法是用甲醇在酸性介质中还原氯酸钠.请配平下列反应方程式,并标出电子转移的方向和数目:
的一种方法是用甲醇在酸性介质中还原氯酸钠.请配平下列反应方程式,并标出电子转移的方向和数目:
□![]() □
□![]() +□
+□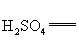 □
□![]() +□
+□![]() +□
+□![]() +□
+□![]()
(3)若上述两个反应中转移等量的电子,则两种方法制得的![]() 的物质的量之比为n(1)∶n(2)=________.
的物质的量之比为n(1)∶n(2)=________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)某厂废水中含KCN,其浓度为650 mg/L.现用氯氧化法处理,发生如下反应(其中N均为-3价): ,被氧化的元素是________.
,被氧化的元素是________.
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气.请配平下列化学方程式,并标出电子转移方向和数目:□KOCN+□KOH+□ □
□![]() +□
+□![]() +□ KCl+□
+□ KCl+□![]()
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯________g.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
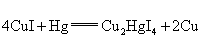
(1)上述反应产物![]() 中,Cu元素显________价.
中,Cu元素显________价.
(2)以上反应中的氧化剂为________,当有1mol CuI参与反应时,转移电子________mol.
(3)CuI可由![]() 与
与![]() 直接反应制得,请配平下列反应的离子方程式.
直接反应制得,请配平下列反应的离子方程式.
□![]() +□
+□![]()
![]() □CuI+□
□CuI+□![]()
查看答案和解析>>
科目: 来源:物理教研室 题型:022

(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现微安培表指针向前述相反方向偏转.试回答:
(1)两次操作过程中指针为什么会发生偏转?
答_________________________________________________________.
(2)两次操作过程中指针偏转方向为什么会相反?试用化学平衡移动的原理解释此现象.
答:_______________________________________________________.
(3)(I)操作过程中![]() 棒上发生的反应为_______________.
棒上发生的反应为_______________.
(4)(II)操作过程中![]() 棒上发生的反应为_______________.
棒上发生的反应为_______________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
试回答:
(1)铝件表面形成氢氧化铝薄膜的电极反应式和离子反应式为:________.
(2)电解过程中,必须使电解液pH保持相对稳定(不能太大,也不能太小)的原因是________.
(3)使用![]() 溶液为电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离子方程式为________________.
溶液为电解液,会减缓阴极区溶液pH的增大,能说明这一原理的离子方程式为________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
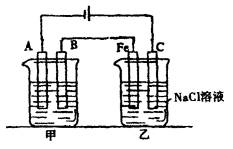
试回答:
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为_______________极,电极材料是_______________,电极反应式为________,电解质溶液可以是________.
(2)乙池中Fe极电极反应式为____________________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈_______________色.
(3)若甲池A极增重12.8g,则乙池C(石墨)极放出气体在标况下的体积为________.
(4)电解后,若乙池剩余溶液为400mL,则溶液的pH=________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com