
科目: 来源:物理教研室 题型:022
①原子序数为42的元素的原子结构示意图为________.
②由此假设而设计的元素同期表中,该元素位于第________周期,第________族.
③该元素的原子在化学反应中显示的化合价可能有________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
查看答案和解析>>
科目: 来源:物理教研室 题型:022
①_________________________;
②_________________________;
③_________________________.
查看答案和解析>>
科目: 来源:物理教研室 题型:022
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1) 用90%浓H2SO4溶解钛铁矿(FeTiO3),反应式为:______________________。
(2) FeTiO3+3H2SO4=FeSO4+Ti(SO4)2+3H2O。在除去不溶性杂质后,结晶析出FeSO4·7H2O时,为保持较高的酸度不能加水,其原因可能为________。
A.防止Fe2+被氧化
B.防止Ti(SO4)2水解
C.减少FeSO4·7H2O的溶解量
D.减少Ti(SO4)2的溶解量
(2)在除去杂质后,又需加大量水稀释以降低酸度,同时加热以生成TiO(OH)2沉淀,过滤,将TiO(OH)2热分解即得钛白粉(TiO2)。除杂后加水稀释和加热的目的是________。
(3)在高温HCl气流中,TiO2可转化为TiCl4,反应方程式为:________。
(4)将TiCl4与Na共熔即可得Ti,反应式为________,若用TiCl4溶液与Na反应制Ti,不能达到预期目的,原因是________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
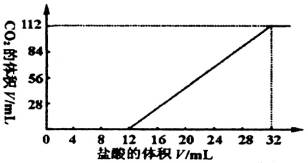
查看答案和解析>>
科目: 来源:物理教研室 题型:022
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)有关Na2O2起反应的化学方程式是______________________________________。
(2)CH4、O2、Na2O2的物质的量之比是______________________________________。
(3)取0.1 mol CH4,向残余固体加足量的酸,能放出________mol气体。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)试分析讨论m与n的比值跟容器内剩余固体的成分,排出的气体的成分之间的关系,填写下表:
|
|
m/n |
剩余固体成分 |
排出的气体 |
|
(1) |
|
Na2CO3 |
O2,CO2,H2O(气) |
|
(2) |
1/2 |
|
|
|
(3) |
1/2<m/n<1 |
|
|
|
(4) |
1 |
|
|
|
(5) |
|
Na2CO3,NaOH,Na2O2 |
|
(2)当排出的气体只含O2和H2O(气),且它们的物质的量相等时,原固体混合物中Na2O2和NaHCO3的物质的量之比为________,写出其推算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com