
科目: 来源:物理教研室 题型:022
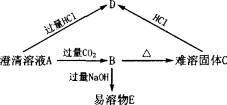
(1)已知A为二元碱,其金属阳离子核外有18个电子,写出各物质的化学式:
A.________________,B.________________,C.________________,
D.________________,E.________________。
(2)写出下列两个变化的离子方程式。
B→D:________;
B→E:________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)Fe(NO3)2溶液![]() 白色沉淀
白色沉淀
(2)Ba(NO3)2溶液![]() 白色沉淀
白色沉淀
(3)某无色溶液![]() 白色沉淀
白色沉淀
(4)某无色溶液![]() 无色溶液
无色溶液![]() 白色沉淀
白色沉淀
你认为白色沉淀一定完全是BaSO4的是________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
①量取amL水样,迅速加人固定剂MnSO4溶液和碱性KI溶液(含有KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2+O2+4OH-═══2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1mL~2mL浓H2SO4(提供H+)使之生成I2,再用bmol•L-1的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL,有关反应的方程式为:MnO(OH)2+2I-+4H+═══Mn2+I2+3H2O、
![]() O
O![]() ═══2I-+
═══2I-+![]() O
O![]() amL水中溶氧的量的计算式是________。
amL水中溶氧的量的计算式是________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
查看答案和解析>>
科目: 来源:物理教研室 题型:022
_____________________________________________________________________________。
该方法与用传统方法制铜相比,最突出的优点是____________________________________。
(2)在冶金工业的烟道废气中,常混有大量的SO2和CO,它们都是大气的污染物,在773K和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫磺。请写出该反应的化学方程式
_____________________________________________________________________________。
(3)作为国家正在实施的“西气东输”工程终点站,上海将逐步改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气主要成分是CH4。它们的燃烧反应如下:
2CO+O2![]() 2CO2 2H2+O2
2CO2 2H2+O2![]() 2O
2O
CH4+2O2![]() CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是________________进风口(填增大或减小),如不作改进可能产生的不良结果是________________________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(2)使用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号)________________________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________________,B瓶溶液作用是________________,C瓶溶液的作用是____________
__________________________________。

(4)装置④中所加的固体药品是________________。可验证的产物是________________。确定装置④在整套装置中的位置的理由是_________________________________________
_____________________________________________________________________________。
(5)装置②中所盛溶液是________________,可验证的产物是________________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022

(1)他能否制得较纯净的Na2CO3?________理由是_________________________________
_____________________________________________________________________________。
按他的设计,第①步实验装置如图所示:
(2)装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石?________________原因是____________________________________________________________________________________________。
(3)装置B使用的试剂是________________,作用是________________。
(4)有人认为验步骤②③的顺序对调,即先混合,再煮沸,更合理,你认为对吗?为什么?
查看答案和解析>>
科目: 来源:物理教研室 题型:022
(1)写出这两种试剂和O2反应的化学方程式________________________________。
(2)除去等质量的O2,所耗N2H4(32g×mol-1)、Na2SO3(126g×mol-1)质量之比为______
________________。
(3)和N2H4相比,用Na2SO3的缺点是____________________________________________
_____________________________________________________________________________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
甲 乙 丙 丁
化合物中
各元素原子
个数比 A∶C=1∶1 B∶A=1∶4 D∶E=1∶3 B∶E=1∶4
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属哪一周期元素?推断依据是什么?
_________________________________________。
_________________________________________。
(2)根据题目提供的条件,推断E在周期表中的族序数所必要的条件是什么?
_________________________________________。
_________________________________________。
(3)向甲的水溶液中加入MnO2,反应的化学方程式
_____________________________________________________________________________。
(4)乙可以燃烧,燃烧时火焰呈蓝色,试写出乙燃烧的化学方程式
_____________________________________________________________________________。(5)D形成的单质在浓硫酸中钝化,而在盐酸中反应生成丙,试解释D在浓硫酸中钝化的原因:
_______________________________________________________________________________
_____________________________________________________________________________。
写出D与盐酸反应生成丙的反应式:
_____________________________________________________________________________。
(6)向3mL1mol×L-1的KI溶液中依次注入下列试剂:①1mL5mol×L-1的盐酸;②0.5mL 30%甲溶液;③1mL丁,经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是什么___________________________________________________________________________________。
查看答案和解析>>
科目: 来源:物理教研室 题型:022
下表是一些气态原子失去核外不同电子所需的能量(KJ×mol-1)
锂 X Y
失去第一个电子 519 502 580
失去第二个电子 7296 4570 1820
失去第三个电子 11799 6920 2750
失去第四个电子 9550 11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。
_____________________________________________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素。用元素符号表示X和j形成化合物的化学式________。
③Y是周期表中________族元素。
④以上13种元素中________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com