
科目: 来源: 题型:022
为测定钢铁中硫的含量,称取0.5000g试样,高温下在氧气中燃烧,使试样中的硫转化为SO2。将燃烧后的气体通入1%的淀粉溶液中进行吸收,并用标准碘溶液进行滴定。
(1)滴定过程中反应的化学方程式是________,达终点时溶液呈________色。
(2)若达滴定终点时消耗b(mL)物质的量浓度为a(mol/L)的碘溶液,则试样中硫的质量分数的计算式为________。
(3)为了快速得出测定结果,配制标准碘溶液时,要使每消耗0.1mLI2溶液相当于试样中含S0.001%,则标准碘溶液的物质的量浓度应是________。
查看答案和解析>>
科目: 来源: 题型:022
环境监测测定水中溶解氧的方法是:
(1)量取a(mL)水迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好塞子,并振荡摇匀,使之充分反应。
(2)测定:开塞后迅速加入适量的硫酸(提供H+)使之生成I2,再用b(mol/L)的Na2SO3溶液滴定(和I2反应)消耗了V(mL)(以淀粉为指示剂)。有关的离子反应方程式为:
①2Mn2++O2+4OH-══2MnO(OH)2(该反应极快);
②MnO(OH)2+2I-+4H+══Mn2++I2+3H2O,I2+2S2O32-══2I-+S4O62-
回答:
(1)水中溶解氧的量(以g/L为单位)的计算式为:________。
(2)滴定时(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由________色变为________色。
(3)测定时,滴定管经水洗、蒸馏水洗之后,直接加滴定剂Na2S2O3会导致结果________。
(填偏高、偏低或无影响)
(4)滴定前滴定管充满Na2S2O3溶液,并已排除气泡,但由于操作不慎,滴定后观察刻度时,发现滴定管下端有气泡,会导致结果________。(填偏高、偏低或无影响)
(5)若打开塞子加H2SO4时动作缓慢,会导致结果________。(填偏高、偏低或无影响)
查看答案和解析>>
科目: 来源: 题型:022
1840年盖斯提出了盖斯定律,不管化学反应是一步完成还是分步完成,这个过程的热效应是相等的,而与过程无关。
(1)已知:N2(g)+2O2(g)ƒ2NO2(g)△H=67.7kJ/mol,
N2H4(g)+O2(g)ƒN2(g)+2H2O(g)△H=-534kJ/mol
由盖斯定律可计算出1mol N2H4和NO2完全反应生成N2和H2O(g)时放出的热量为kJ。该反应的热化学方程式为________。
(2)使m(g)SO2和n(g)S在碱性溶液中作用,恰好完全反应生成S2O32-;若先使n(g)S在碱性溶液中发生反应,生成Sx2-和S2O32-,然后通入m(g)SO2也生成S2O32-。各反应都在相同条件下进行。两种途径的反应热是否相同?________,两种途径生成S2O32-的物质的量是否相同?________。
查看答案和解析>>
科目: 来源: 题型:022
(1)已知PbSO4难溶于水,而Pb(CH3COO)2易溶于水,但PbSO4能溶于CH3COONH4:
PbSO4+2CH3COONH4══Pb(CH3COO)2+(NH4)2SO4,此复分解反应能发生的原因是:________。
(2)已知t(℃)时,四种化合物在水中及液氨中的溶解度数据如下:
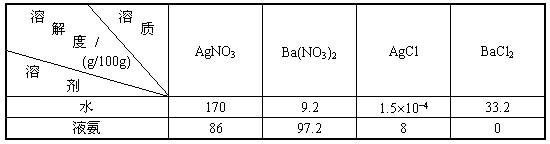
写出t(℃)时上述几种化合物分别在水溶液和液氨中能发生复分解反应的化学方程式:
水中:________;液氨中:________。
查看答案和解析>>
科目: 来源: 题型:022
一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu══2Fe2++Cu2+的拆写结果是:氧化反应为:
Cu-2e-══Cu2+;还原反应为:2Fe3++2e-══2Fe2+(式中e-为转移的电子)。
(1)请据此将反应:3NO2+H2O══2H++2NO3-+NO拆写成两个“半反应式”。
氧化反应________,还原反应________。
(2)已知某一反应的半反应式为CH4+10OH--8e-══CO32-+7H2O,O2+2H2O+4e-══4OH-。
则总反应方程式为________。
查看答案和解析>>
科目: 来源: 题型:022
化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如图所示循环:

(1)在上述有编号的步骤中,需用还原剂的是________,需用氧化剂的是_________。(填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是________。(填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□________
查看答案和解析>>
科目: 来源: 题型:022
金刚石晶体中,最小的C原子环上有________个C原子,SiO2晶体中最少的Si—O原子环上有________个Si原子,________个O原子。12g金刚石晶体中含化学键数为________,
60g SiO2晶体中化学键数为__________。
查看答案和解析>>
科目: 来源: 题型:022
近年来,乳酸CH3CH(OH)COOH成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水。请回答下列有关问题:
(1)乳酸在发生下列变化时所用的试剂是①_____________,②_______________;
CH3CH(OH)COOH![]() CH3CH(OH)COONa
CH3CH(OH)COONa![]() CH3CH(ONa)COONa
CH3CH(ONa)COONa
(2)由乳酸可以制取![]() 请写出设计合成实验时所涉及的有机反应类型:
请写出设计合成实验时所涉及的有机反应类型:
___________________________________________________________________________。
(3)聚乙烯、聚苯乙烯材料因难分解而给人类生存环境带来严重的“白色污染”,德国Danone公司开发了聚乳酸材料![]() ,它是由乳酸通过______________反应制取的。
,它是由乳酸通过______________反应制取的。
聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程_____________________________________________________________。
(4)若碳原子以单键与四个不同的原子或原子团相结合,则称该碳原子为“手性碳原子”,含有手性碳原子的分子称为“手性分子”,手性分子往往具有一定生物活性。乳酸分子是手性分子,乳酸[③CH3②CH(OH)①COOH]的手性碳原子是____________号碳原子。
(5)乳酸的某种同分异构体具有下列性质:能发生银镜反应;1mol该物质跟足量金属钠发生缓慢反应,生成2g氢气;该分子为手性分子。写出该物质的结构简式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com