
科目: 来源:学习高手必修一化学人教版 人教版 题型:022
A、B是两种常温下有刺激性气味的气体.将A(g)通入品红溶液中,品红溶液变为无色;将B(g)通入品红溶液中,品红溶液也变为无色.将A(g)通入紫色石蕊试液中,溶液变为红色;将B(g)通入紫色石蕊试液中,溶液先变红后褪色.将A(g)和B(g)按1∶1的体积比充分混合,通入品红溶液中,品红溶液不褪色,通入紫色石蕊试液中,溶液只变红不褪色.试回答下列问题:
(1)写出A、B的化学式:A________,B________.
(2)写出A与NaOH(aq)反应的化学方程式:________或________.
(3)写出B与NaOH(aq)反应的离子方程式:________.
(4)加热通入A(g)后变为无色的品红溶液,现象是________;加热通入B(g)后变为无色的品红溶液,现象是_______________.
查看答案和解析>>
科目: 来源:学习高手必修一化学人教版 人教版 题型:022
有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用.
(1)推断X、Y、Z三种元素的名称:X________,Y________,Z________.
(2)化合物的化学式:XZ________,X2Y________.
(3)五个过程中涉及的化学方程式为________,________,________.
查看答案和解析>>
科目: 来源:学习高手必修一化学人教版 人教版 题型:022
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2→X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W________;X________;Y________;
Z________.
(2)以上4个化学反应中,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是________(写化学式),还原剂是________(写化学式).
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________;
②化学方程式:________.
查看答案和解析>>
科目: 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:022
A、B、C、D均为短周期元素.A元素原子的核外有两个电子层,最外层已达到饱和.B元素位于A元素的下一周期,最外层的电子数是A元素最外层电子数的1/2.C元素的离子带有两个单位正电荷,它的核外电子排布与A元素原子相同.D元素与C元素属于同一周期,D元素原子的最外层电子数比A的最外层电子数少1.
根据上述事实判断:
(1)A________,B________,C________,D________.
(2)B元素位于第________周期________族,它的最高价氧化物的化学式是,最高价氧化物对应水化物的化学式为________.
查看答案和解析>>
科目: 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:022
不同元素原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力就越强,在所形成的分子中成为负电荷偏向的一方;若x越小,其原子吸引电子的能力就越弱,在所形成的分子中成为负电荷偏离的一方.下列是某些短周期元素的x值.
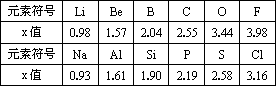
(1)某卤素化合物IBr中,共用电子对偏向________元素.
(2)分析x值变化规律,确定Mg、N的x值范围________<x(Mg)<________;________<x(N)<________.
(3)测得x值与原子半径的关系________;根据短周期元素的x值变化特点,体现了元素性质________的规律.
(4)经验规律告诉我们,当两成键原子相应元素的差值Δx>1.7时,一般认为形成离子键,当Δx<1.7时形成共价键,试推断AlBr3中化学键的类型.
(5)推测周期表中,x值最小的元素位置(放射性元素除外)________.
查看答案和解析>>
科目: 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:022
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.

(1)写出A、B、C三种元素的名称:________、________、________.
(2)B位于元素周期表中第________周期、第________族.
(3)C的原子结构示意图为,C的单质与水反应的化学方程式为________.
(4)比较B、C的原子半径BC.写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式________.
查看答案和解析>>
科目: 来源:必修一导学指导化学苏教版 苏教版 题型:022
已知氧化还原反应:(1)2Fe3++2I-![]() 2Fe2++I2,(2)2Fe2++Br2
2Fe2++I2,(2)2Fe2++Br2![]() 2Fe3++2Br-,(3)2Br-+Cl2
2Fe3++2Br-,(3)2Br-+Cl2![]() Br2+2Cl-,现向含a mol FeI2和b mol FeBr2的混合液中逐渐通入c mol Cl2,反应随Cl2通入明显分成几个阶段进行,试分析在c值增大过程中,不同c值范围内被氧化的离子及被氧化离子的物质的量(用含a、b、c代数式表示)为:
Br2+2Cl-,现向含a mol FeI2和b mol FeBr2的混合液中逐渐通入c mol Cl2,反应随Cl2通入明显分成几个阶段进行,试分析在c值增大过程中,不同c值范围内被氧化的离子及被氧化离子的物质的量(用含a、b、c代数式表示)为:
(1)0<c≤a:________
(2)a<c≤![]() :________
:________
(3)![]() <c≤
<c≤![]() :________
:________
查看答案和解析>>
科目: 来源:必修一导学指导化学苏教版 苏教版 题型:022
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如下图所示.请填空回答:
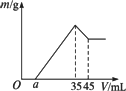
(1)H2SO4溶液的物质的量浓度为________.
(2)若a=2.3,用于沉淀Fe3+,消耗NaOH的体积是________mL,铝土矿中各组成成分的质量分数:Al2O3________,Fe2O3________,SiO2________.
(3)a值的范围应是________,在这个范围内,a值越大,________的质量分数越小.
查看答案和解析>>
科目: 来源:必修一导学指导化学苏教版 苏教版 题型:022
取等物质的量浓度的NaOH溶液两份,分别记为A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为________mol·L-1.
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式)________;其物质的量之比为________.
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为________mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com