
科目: 来源:湖南省宜章一中2009-2010学年高二上学期期中考试化学试题 A 题型:022
在2 L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=________.
已知:![]() >
>![]() ,则该反应是________热反应.
,则该反应是________热反应.
(2)下图中表示NO2的变化的曲线是________.

用O2表示从0~2 s内该反应的平均速率v=________.
(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
科目: 来源:黑龙江省哈四中2010届高三上学期期中考试化学试题 题型:022
下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最多的金属元素,G是气体,J是磁性材料,A可做颜料.根据图示回答问题:

(1)写出下列物质的化学式:A________ I________
(2)在周期表中的位置________.
(3)反应①的离子方程式是____________________________
(4)反应②的化学方程式是____________________________
(5)F与过量的CO2反应的离子方程式是________________
查看答案和解析>>
科目: 来源:黑龙江省哈四中2009-2010学年高二上学期期中考试化学(理科)试题 题型:022
对于2X(g)![]() Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).

(1)该反应的正反应方向是一个________反应(填“吸热”或“放热”).
(2)A、B、C、D、E各状态中,
v正<v逆的是________.(3)维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x________y(填“<、>或=”).
(4)欲要求使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是________.
查看答案和解析>>
科目: 来源:黑龙江省哈四中2009-2010学年高二上学期期中考试化学(理科)试题 题型:022
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0
2SO3(g)ΔH<0
(1)写出该反应的化学平衡常数表达式K=________
(2)降低温度,该反应K值________,二氧化硫转化率________,化学反应速率________.(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将SO2和O2混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________.(有几段填几段)
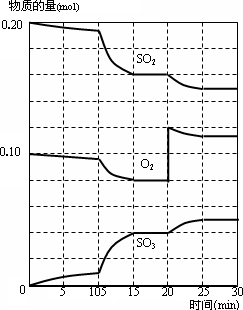
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达).10 min到15 min的曲线变化的原因可能是________(填写编号).
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
查看答案和解析>>
科目: 来源:广东省汕头市澄海中学2009-2010学年高二上学期期中考试化学试卷(理) 题型:022
已知水在25℃和95℃时,其电离平衡曲线如图所示:
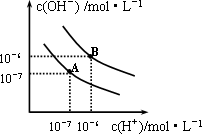
(1)则25℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由________
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合
后,混合溶液的pH=5.请分析其原因:________________
查看答案和解析>>
科目: 来源:广东省汕头市澄海中学2009-2010学年高二上学期期中考试化学试卷(理) 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:广东省汕头市澄海中学2009-2010学年高二上学期期中考试化学试卷(理) 题型:022
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示.根据图示回答下列问题:

①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa.该反应的平衡常数等于________.
②平衡状态由A变到B时.平衡常数K(A)________K(B)(填“>”、“<”或“=”).
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2整个过程中转移的电子总数为________(阿伏加德罗常数的值用NA表示),放出的热量为________kJ.
查看答案和解析>>
科目: 来源:广东省汕头市澄海中学2009-2010学年高二上学期期中考试化学试卷(理) 题型:022
在密闭容器中投入一定量的A和B发生反应:
mA(g)+nB(g)![]() pC(g)+qD(g)
pC(g)+qD(g)
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol.
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图所示.则T1(填“>”、“<”或“=”)________T2,该反应的正反应的ΔH(填“>”、“<”或“=”)________0.
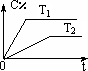
(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如图所示,测得达到平衡时A、B、C、D的物质的量均为1 mol.

①若在恒温恒容的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)________.
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)________.
查看答案和解析>>
科目: 来源:学习高手必修一化学人教版 人教版 题型:022
A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种.
①A与B反应有气体生成
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体生成
⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是________.
(2)A是________,B是________,C是________,D是________,E是________.
(3)A与E反应的离子方程式是________.
查看答案和解析>>
科目: 来源:学习高手必修一化学人教版 人教版 题型:022
根据下列变化进行推断:
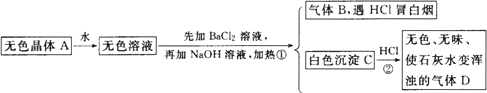
且已知对A加强热产生的气态物质的平均相对分子质量为26.3.
(1)推断A、B、C、D的化学式:A________,B________,C________,D________.
(2)写出①②变化的离子方程式:
①________;
②________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com