
科目: 来源:甘肃省民乐一中2009-2010学年高二下学期期末考试化学试题 题型:022
有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系:

(1)X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3∶2;Z元素原子的次外层电子数是其最外层电子数的4倍.则:
①写出化合物甲的电子式________;
②
写出Z与甲反应的化学方程式________;(2)X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂.则:
①写出X与NaOH溶液反应的离子方程式________;
②
在①所得溶液中加入乙的溶液,观察到的现象________________;(3)X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质.则:
①写出乙与NaOH溶液反应的化学方程式________;
②
将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解后,得到气体的质量之比是________.查看答案和解析>>
科目: 来源:2010年高三备考“好题速递”系列(18)化学试题 题型:022
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染.PETG的结构简式为:
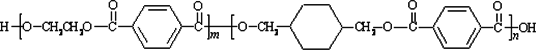
已知:Ⅰ.![]()
Ⅱ.RCOOR1+R2OH
→RCOOR2+R1OH(R、R1、R2表示烃基)这种材料可采用下列合成路线
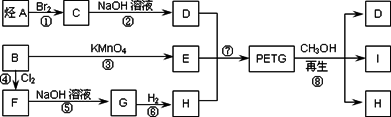
试回答下列问题:
(1)合成PETG的单体有________种.
(2)指出反应类型:②________ ⑥________.
(3)写出A、B、I的结构简式:A________,B________,I________.
(4)G属于酚类的同分异构体有多种,其中酚羟基互为间位的同分异构体共有________种.
(5)反应⑦中参加反应的D、E、H的物质的量之比为________.
查看答案和解析>>
科目: 来源:2010年高三备考“好题速递”系列(18)化学试题 题型:022
氮是地球上极为丰富的元素.
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为________.
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的________键比________键稳定(填“![]() ”“
”“![]() ”).
”).
(3)(CH3)3NH+和AlCl-4可形成离子液体.离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作________(填代号).
a、助燃剂 b、“绿色”溶剂 c、复合材料 d、绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成 的晶体结构如图所示.X的元素符号是________,与同一个N3-相连的X+有________个.

查看答案和解析>>
科目: 来源:2010年高三备考“好题速递”系列(18)化学试题 题型:022
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g).某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.根据图示回答下列问题:
2SO3(g).某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.根据图示回答下列问题:
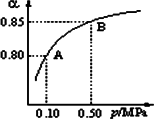
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa.该反应的平衡常数等于________.
②平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”)
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
CH4
(g)+4NO(g)若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数的值用NA表示),放出的热量为________kJ.
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去.转化流程如图所示:

请写出MFe2Ox分解SO2的化学方程式________(不必配平)
查看答案和解析>>
科目: 来源:重庆市万州二中2011届高三秋季入学考试化学试题 题型:022
有机物A可发生如下转化:

(1)化合物A是一种邻位二取代苯,其中一个取代基是羧基,则A的结构简式是________.
(2)反应①②都可属于取代反应.其中①是________反应,②是________反应
(3)反应③的化学方程式是________.
(4)A与NaOH溶液共热,可发生反应生成B与C的钠盐.与1 mol A反应所消耗的NaOH物质的量为________mol.
(5)与A具有相同官能团(-COOH和-COO-)的A的同分异构体很多,请写出其中三种邻位二取代苯的结构简式________、________、________.
查看答案和解析>>
科目: 来源:重庆市万州二中2011届高三秋季入学考试化学试题 题型:022
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:

下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.
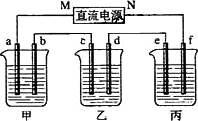
接通电源,经过一段时间后,测得乙中c电极质量增加了16 g.常温下各烧杯中溶液的pH与电解时间t的关系图如下.据此回答下列问题:

(1)M为电源的________极(填写“正”或“负”)电极b上发生的电极反应为________;
(2)计算电极e上生成的气体在标准状态下的体积:________;
(3)写出乙烧杯的电解池反应________
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?________________
(5)若经过一段时间后,测得乙中c电极质量增加了16 g,要使丙恢复到原来的状态,操作是________________.
查看答案和解析>>
科目: 来源:重庆市万州二中2011届高三秋季入学考试化学试题 题型:022
中学化学中几种常见物质的转化关系如下:

将D溶液滴入沸水中可得到以F为分散质的红褐色液体.请回答下列问题:
(1)写出D溶液滴入沸水中可得到红褐色液体的离子方程式是________.此液体具有的性质是________.(填写序号)
①光束通过该液体时形成光亮的“通路”.
②插入电极通直流电后,有一极附近液体颜色加深.
③向该液体中加入硝酸银溶液,无沉淀产生.
④将该液体加热、蒸干、灼烧后,有氧化物生成.
(2)A、B、H的化学式:A________ B________ H________.
(3)①H2O2分子的电子式:________
②写出C的酸性溶液与双氧水反应的离子方程式________.
(4)写出鉴定E中阳离子的实验方法和现象:________________.
(5)在C溶液加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:________.
查看答案和解析>>
科目: 来源:浙江省温州市十校联合体2011届高三上学期联考化学试题 题型:022
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO![]() 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO![]() 离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除天平、药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是________.

(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4![]() ZnSO4+H2↑;MnO2+4HCl(浓)
ZnSO4+H2↑;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).
可选用制备气体的装置:

查看答案和解析>>
科目: 来源:浙江省温州市十校联合体2011届高三上学期联考化学试题 题型:022
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:________.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g);ΔH=-90.8 kJ·mol-1
CH3OH(g);ΔH=-90.8 kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号).
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(3)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
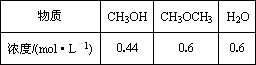
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”).
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________.
查看答案和解析>>
科目: 来源:浙江省温州市十校联合体2011届高三上学期联考化学试题 题型:022
有机物A(C6H8O4)为食品包装纸的常用防腐剂.A可以使溴水褪色.A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇.通常状况下B为无色晶体,能与氢氧化钠溶液发生反应.
(1)A可以发生的反应有________(选填序号).
①加成反应
②酯化反应
③加聚反应
④氧化反应
(2)B分子所含官能团的名称是________.
(3)B分子中没有支链,其结构简式是________,B的具有相同官能团的同分异构体的结构简式是________.
(4)由B制取A的化学方程式是________.
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
天门冬氨酸的结构简式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com