
科目: 来源:2010年高二“每周一练”系列(15)化学试题 题型:022
1 mol某烃A充分燃烧可以得到8 mol CO2和4 mol H2O,烃A可通过下图所示各个反应,得到多种化合物及某种聚合物.
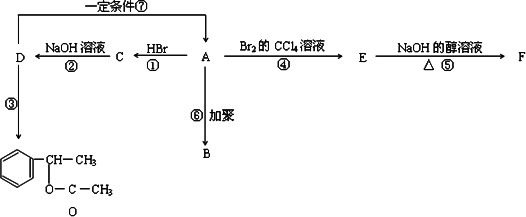
回答:
(1)写出下列物质的结构简式:
A________、B________、D________、E________.
(2)写出F可能的结构简式________.
(3)以上①~⑦反应中属于取代反应的是________,属于消去反应的是________(填序号).
(4)写出下列反应的化学方程式(有机物用结构筒式表示)
①______________________.
②______________________.
查看答案和解析>>
科目: 来源:四川省成都外国语学校2011届高三10月月考化学试题 题型:022
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:四川省成都外国语学校2011届高三10月月考化学试题 题型:022
如图所示
,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2SO2(g)+O2(g)
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA________PB(填“<”、“=”、“>”).
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在________处.
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x和y的关系是x________y.(填“<”、“=”、“>”).
查看答案和解析>>
科目: 来源:四川省成都外国语学校2011届高三10月月考化学试题 题型:022
在一定温度下
,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中(如图)发生以下的反应: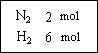
若反应达到平衡后,测得混和气体为7 mol,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1 mol,c=2 mol,则b=________mol,在此情况下,反应起始时将向________方向进行(填“正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是________.
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是________.
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2011届高三10月月考化学试题 题型:022
取物质的量浓度相等的NaOH溶液两份甲和乙,每份50 mL,分别向甲、乙中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的HCl溶液,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如下图所示,试回答下列问题:
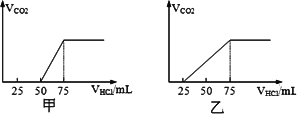
试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是________,其物质的量之比是________,产生的CO2气体体积(标况)是________.在乙所得溶液中存在的溶质是________,其物质的量之比是________,产生的CO2气体体积(标况)是________.
查看答案和解析>>
科目: 来源:浙江省东阳中学2009-2010学年高一下学期期中考试化学试题 题型:022
下图是元素周期表的部分框架,请回答:
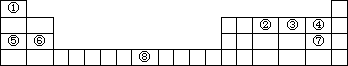
(1)根据元素周期表回答下面问题:
a)元素周期表中的元素⑤和元素⑥的最高价氧化物的水化物中碱性较强是________(用分子式表示).周期表中的元素④和元素⑦的气态氢化物中沸点较高的是________(用结构式表示),理由是________.
b)元素①-⑦中的某单质在常温下化学性质稳定,通常可以做保护气的是________(用电子式表示).元素①和②形成的化合物,在工业制硝酸中催化氧化制NO,写出反应式________.
c)碳、氢、氧三种元素能形成许多种化合物,有些分子还会形成同分异构体,写出与乙醇(下图)互为同分异构体的有机化合物的结构式________
(2)元素周期表中位于斜对角线的两种元素及其性质十分相似,称之为对角线原则.根据元素周期表对角线原则,金属Be与铝单质及其化合物性质相似.
a)写出证明Al2O3是两性物质的化学反应的离子方程式:________,________.
b)Be(OH)2和Mg(OH)2可用试剂________鉴别.
查看答案和解析>>
科目: 来源:浙江省东阳中学2009-2010学年高一下学期期中考试化学试题 题型:022
有A、B、C、D、E五种短周期元素,其中A、B、C三元素在元素周期表中的位置如图所示,已知B原子核内质子数和中子数相等,A、B、C三种元素的原子核外电子数之和等于B的质量数,B、D、E属于同一周期,D元素原子的最外层只有一个电子,E元素的质子比D元素的质子数多两个.据此填空:
(1)A元素的非金属强的最有力的依据是________,B元素的单质熔化时需破坏________(填作用力名称),A、B、C、D、E的单质中,氧化性最强的单质的化学式为________.
(2)A的氢化物的结构式为________,空间构型为________,属于________(填“共价”或“离子”)化合物.其溶于水呈碱性的原因是________(用方程式表示)
(3)B、C气态氢化物的热稳定性的顺序为________.
(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为________.
查看答案和解析>>
科目: 来源:浙江省东阳中学2009-2010学年高二下学期期中考试化学试题 题型:022
一定温度下,将3 mol A气体和1 mol B气体通人一密闭容器中,发生如下反应:3A(g)+B(g)![]() nC(g).请填写下列空白:
nC(g).请填写下列空白:
(1)
若容器体积固定为2 L,2 min时测得剩余0.6 mol B,C的浓度为0.4 mol·L-1.①2 min内,A的平均反应速率为________;n=________;
②若反应从起始经4 min达到平衡,平衡时C的浓度________0.8 mol/L(填“>”、“<”或“=”);假设此时C的体积分数为x%
③若改变起始物质加入的量,欲使反应达到平衡时C的体积分数仍为x%,则起始加入的A、B、C三种物质的物质的量a、b、c之间应该满足的关系式为________、________.(分别用含a、c和含b、c的两个式子表示)
(2)
若维持容器压强不变:其它条件均与题(1)相同①此时达到平衡时C的体积分数为y%,则比较x________y(填“>”、“<”、“=”);
②改变起始物质加入的量,欲使反应达到平衡时C的体积分数仍为y%,则起始加入的A、B、C三种物质的物质的量a、b、c之间应该满足的关系式为________.
查看答案和解析>>
科目: 来源:浙江省东阳中学2009-2010学年高二下学期期中考试化学试题 题型:022
如下图所示,常温下U形管内盛有100 mL的溶液,请按要求回答下列问题:

(1)若所盛溶液为CuSO4溶液,打开K2,合并K1,则:A为________极,B极的电极反应式为________.
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,合并K2,则:
①、________极(填A或B)溶液先变红色,原因是________
②、电解池的离子方程式是________
③、反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(折算成标准状况)为11.2 mL,若将溶液充分混合,溶液的pH为________
查看答案和解析>>
科目: 来源:浙江省东阳中学2009-2010学年高二下学期期中考试化学试题 题型:022
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的PH如下表:请回答:

(1)从①组的情况分析,HA是强酸还是弱酸________
(2)②组情况表明,c________0.2(选填“>”、“<”或“=”)
(3)从③实验结果分析,说明HA的电离程度________NaA的水解程度(选填,>”、“<”或“=”)该混合溶液中离子浓度由大到小的顺序是________
(4)①组实验所得混合溶液中由水电离出来的c(OH-)是________mol·L-1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com