
科目: 来源:福建省四地六校联考2010-2011学年高二第三次月考化学试题 题型:022
已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1,500℃时将2 mol SO2和1 mol O2装入一体积恒定的10 L密闭容器中,2分钟(t1)时达到平衡.如下图所示:
2SO3(g) ΔH=-196 kJ·mol-1,500℃时将2 mol SO2和1 mol O2装入一体积恒定的10 L密闭容器中,2分钟(t1)时达到平衡.如下图所示:
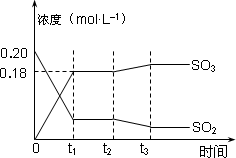
回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为________mol·L-1·min-1.计算500℃时该反应的平衡常数K=________.
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:图中时刻t2发生改变的条件可能是________(写一个即可).
(3)在上述条件下起始装入的SO2和O2各2 mol,达平衡后设SO2的转化率为x,列出求x的方程________.(不必求出x)
(4)某温度时,该反应的平衡常数K=5000,则该温度________500℃(填“>”、“<”、“=”).
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2 mol、y mol、w mol,达到平衡时各组分的含量与第(3)完全相同,则y=________mol.刚开始时反应向________(填“正”或“逆”)反应方向进行.
查看答案和解析>>
科目: 来源:福建省四地六校联考2010-2011学年高二第三次月考化学试题 题型:022
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质的名称是________,上述离子浓度大小顺序关系中正确的是(选填序号)________.
(2)若上述关系中C是正确的,则溶液中溶质的化学式是________.
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)________c(Cl-).
查看答案和解析>>
科目: 来源:福建省四地六校联考2010-2011学年高二第三次月考化学试题 题型:022
25℃时,(1)、将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)________c(CH3COO-)(填“>”或“=”或“<”).
(2)、pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________,溶液中
c(Na+)________c(CH3COO-)(3)、物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________,醋酸体积________氢氧化钠溶液体积.
(4)、将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)________氢氧化钠溶液中c(OH-),m与n的大小关系是m________n.
(5)、相同物质的量浓度的
NH4HSO4和(NH4)2SO4溶液,都呈________性,前者显酸性的主要原因是________;后者显酸性的主要原因是________.查看答案和解析>>
科目: 来源:福建省三明一中2011届高三上学期第三次月考化学试题 题型:022
常温下
,已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合后,所得溶液显酸性;0.01 mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性.请回答下列问题:(1)高碘酸是________(填“强酸”或“弱酸”)
(2)0.01 mol/L的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合后所得溶液中,c(IO3-)________c(Na+)(填“大于”、“小于”或“等于”).
(3)已知某溶液中只存在OH-、H+、IO4-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
A.c(Na+)>c(IO4-)>c(OH-)>c(H+)
B.c(IO4-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(OH-)>c(IO4-)>c(H+)
D.c(IO4-)>c(Na+)>c(H+)>c(OH-)
填写下列空白:
①若溶液中只有一种溶质,则该溶质是________,上述四种离子浓度大小顺序为________(填选项的标号)
②若上述关系中C项是正确的,则溶液中的溶质有________、________
查看答案和解析>>
科目: 来源:福建省三明一中2011届高三上学期第三次月考化学试题 题型:022
回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-.在NaHSO4溶液中c(H+)________c(OH-)+c(SO42-)(填“>”、“=”或“<”).
(2)常温下,向1.0 mol/L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示.a、b、c、d分别表示实验时不同阶段的溶液.其中b点所示溶液呈________(填“酸性”、“中性”或“碱性”),c点所示的离子方程式为________.

(3)在t℃时,将NaHSO4晶体加入到pHH=6的蒸馏水中,保持温度不变,测得溶液的pHH为2.t℃将________25℃(填“高于”或“低于”),Kw=________,在该溶液中由水电离出的c(H+)为________mol/L.t℃时,将pH=11的NaOH溶液V1 L与pH=1的H2SO4溶液V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________,此溶液中各种离子的浓度由大到小的排列顺序为________.
(4)在0.1 mol/L的
①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c(NH4+)由大到小的排列顺序为________.(用序号填空)查看答案和解析>>
科目: 来源:福建省三明一中2011届高三上学期第三次月考化学试题 题型:022
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值________(填“一定增大”“一定减小”或“可能增大也可能减小”).
(2)在一体积为10 L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O(g)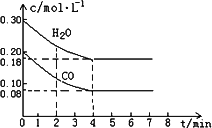
①0-4 min间平均反应速率v(CO)=________mol·L-1·min-1
②在800℃时该反应的化学平衡常数K=________(要求写出表达式及数值);CO的转化率=________.
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:________.
(3)
25℃时,Ksp=5.61×10-12,Ksp=7.42×10-11.下列说法正确的是________A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp和在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃时,
某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol·L-1,则溶液的pH=9(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是________.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目: 来源:福建省三明一中2010-2011学年高一上学期第二次月考化学试题 题型:022
某校化学课外兴趣小组同学在做铜与浓硝酸、稀硝酸反应实验时发现:“相同质量的铜分别与等体积足量的浓硝酸、稀硝酸充分反应后,前者溶液颜色是绿色的,后者溶液的颜色是蓝色的.
(1)一种观点认为:这可能是Cu2+浓度差异所致,你同意这种看法吗?(填“同意”或“不同意”)________,原因是________;
(2)另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.
为了验证推断是否正确,甲、乙、丙三位同学分别设计了三种方案进行验证:
甲方案:将盛绿色溶液的试管加热,看是否有红棕色气体产生.
乙方案:往绿色溶液试管加入一定量的蒸馏水,观察该试管溶液是否变为蓝色.
丙方案:在通风橱内,将一根下端弯成螺旋状且可抽动的铜丝插在盛有足量浓硝酸的试管甲中,立即可观察到试管中充满红棕色的NO2气体.将气体经导管通入到倾斜的另一支盛有淡蓝色Cu(NO3)2试管乙内,随着实验进行,试管乙中的溶液蓝色加深,很快又变成绿色,继续通入NO2,绿色保持不变,向上抽起铜丝,使反应停止.
请根据以上三位同学的方案回答下列问题:
①甲方案有明显不妥之处.试用化学反应方程式加以说明:________.
②请用化学方程式表示乙方案中的反应原理________.
③根据丙方案进行操作,若出现的现象与其叙述的现象相同,则能否证明第二种观点是正确?________;(填“能”或“不能”)
查看答案和解析>>
科目: 来源:福建省三明一中2010-2011学年高一上学期第二次月考化学试题 题型:022
A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
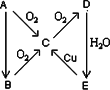
(1)若A在常温下为气态单质:
(a)则A为________;B为________;C为________;D为________;E为________;
(b)C→D变化的化学方程式________.
(c)A→B变化的化学方程式________;该反应的工业用途是________.
(d)写出B→C变化的化学方程式________.
(2)若A在常温下为固态单质,B是具有臭鸡蛋气味的有毒气体:
(a)B为________;C为________;E为________;
(b)B与C在集气瓶中混合时发生反应的化学方程式________;反应现象是________.
(c)E→C变化的化学方程式________.
查看答案和解析>>
科目: 来源:福建省三明一中2010-2011学年高二上学期第二次月考化学试题 题型:022
(1)在25℃条件下将pH=10的氨水稀释100倍后溶液的pH为(填序号)________.
A.8
B.10
C.10~12之间
D.8~10之间
(2)25℃时,向0.1 mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,最主要原因是(填序号)________.
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1 mol NH4Cl和0.05 mol NaOH全部溶于水,形成混合溶液(假设无损失).
①________和________两种粒子的物质的量之和等于0.1 mol.
②________和________两种粒子的物质的量之和比OH-多0.05 mol.
(4)已知某溶液中只存在NH4+、Cl-、H+、OH=四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质是________,上述离子浓度大小顺序关系中正确的是(选填序号)________.
②若上述关系中C是正确的,则溶液中溶质的化学式是________.
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系:c(NH4+)________c(Cl-).
查看答案和解析>>
科目: 来源:福建省古田一中2011届高三上学期期中考试化学试题 题型:022
工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂.以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程.
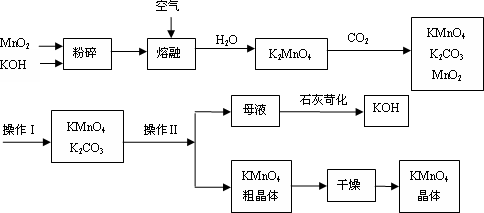
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是________(填代号).
a.84消毒液(NaClO溶液)
b.双氧水
c.苯酚
d.75%酒精
(2)上述流程中可以循环使用的物质有________、________(写化学式).
(3)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得________mol KMnO4.
(4)操作Ⅰ的名称是________;操作Ⅱ是根据KMnO4![]() 和K2CO3两物质在________(填性质)上差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体的.
和K2CO3两物质在________(填性质)上差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体的.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com