
科目: 来源:福建省泉州一中、国光中学2010-2011学年高一上学期期末联考化学试题 题型:022
海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图.

回答下列问题:
(1)请写出电解食盐水的化学方程式________
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁.
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是:______________.
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是________.
③电解熔融氯化镁的化学方程式是________.
④电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)________.
A.H2 B.CO2 C.
空气 D.Ar(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质
①生成溴单质的化学反应的离子方程式是________.
工业生产中将溴单质从混合物中分离出来应采用________(填实验方法).
②以下是对生产溴单质所用的氯气寻找货源的设想,其中合理的是________(填写代号).
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
D.从本厂生产镁单质处循环
查看答案和解析>>
科目: 来源:河北省正定中学2011届高三上学期第四次月考化学试题 题型:022
A、D、E、X、Y五种短周期元素,它们的原子序数依次增大,A元素的原子
是半径最小的原子,D元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐;X与A同主族;Y元素的最外层电子数是其次外层电子数的![]() 倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物.
倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物.
(1)画出Y元素离子的结构示意图________;写出常温下Y的氢化物与其最高价氧化物对应水化物的浓溶液反应的化学方程式________.
(2)由A、D、E、Y四种元素形成的强酸的酸式盐的名称为________,该盐的水溶液中各离子浓度由大到小的顺序为________.
(3)科学家用D、E、X三种元素形成的化合物XDE3和X2E,在573 K时反应制得了离子化合物X3DE4;经测定X3DE4中各原子的最外层电子都达到了8电子稳定结构,则DE43-的电子式为________,X3DE4与水能剧烈反应转化为常见物质,写出反应的化学方程式:________.
查看答案和解析>>
科目: 来源:河北省正定中学2011届高三上学期第四次月考化学试题 题型:022
现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________.
(2)④⑤⑥⑦⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________.
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是________.
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)________25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________.
(5)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pHx和y的关系式________(填
表达式).
查看答案和解析>>
科目: 来源:河北省冀州中学2010-2011学年高二上学期第三次月考化学试题 题型:022
下列框图中的物质均为中学化学常见物质,其中A、B、C、D、F、H为单质,常温常压下A、C、D为气体,B、F、H为金属,且F、H为生活中常见金属,其余为化合物.
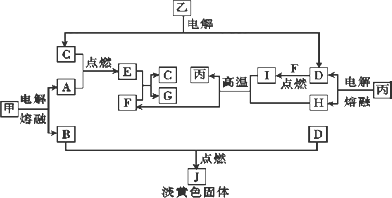
请回答下列问题:
(1)J的电子式为________,生成1 mol I转移________ mol电子.
(2)写出下列反应的化学方程式:
丙→D+H:________.
(3)J+乙→D+K,当把K的溶液滴入G的溶液中时,产生的现象为________.
查看答案和解析>>
科目: 来源:河北省黄骅中学2011届高三上学期期中考试化学试题 题型:022
下图为中学化学中几种常见物质的转化关系(部分产物已略去).已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂.

(1)写出化学式A________,D________,F________,
写出电子式G________;
(2)鉴定G中阳离子的实验方法和现象________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式________.
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目________.
查看答案和解析>>
科目: 来源:河北省黄骅中学2010-2011学年高二上学期期中考试化学试题 题型:022
高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=________、CO的平衡转化率=________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________.
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
查看答案和解析>>
科目: 来源:广东省广州市白云中学2011届高三第二次月考化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:广东省东莞市光明、常平、厚街、万江四校2010-2011学年高二上学期期中联考化学试题 题型:022
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省广河二中2010-2011学年高二上学期期中考试化学试题 题型:022
有两密闭容器A和B,A容器中有一个可移动的活塞使容器内保持恒压,B容器保持恒容,起始时向这两容器中分别冲入等量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等.保持一定温度下使之发生如下反应2SO2(g)+O2(g)![]() 2SO3(g),填写下列空格:
2SO3(g),填写下列空格:
(1)达到平衡所需的时间A容器比B容器________;
(2)A容器中SO2的转化率比B容器________.
(3)达到平衡后,若向两容器中分别通入数量不多的氩气,A容器化学平衡向________移动,B容器化学平衡________移动
(4)达到平衡时,若向两容器中通入等量的原反应气体,重新达到平衡时,A容器SO2的体积分数与原平衡比较则________,B容器中SO3的体积分数比原平衡________.
查看答案和解析>>
科目: 来源:福建省四地六校联考2011届高三第三次月考化学试题 题型:022
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)500℃时,
在体积为1 L的容积固定的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.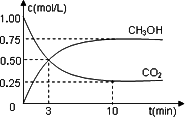
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol·L-1·min-1.
②该反应的平衡常数K=________(保留一位小数),平衡时H2的转化率为________.
③已知温度升高,K值减小.下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆.可减少CO2排放多达45%.
①已知:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
则反应
CH3OH(g)+②
甲醇质子交换膜燃料电池的结构示意图如下,已知H+移向通入O2的电极,甲醇进入________极(填“正”或“负”),正极发生的电极反应为________.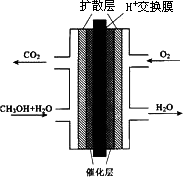
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com