
科目: 来源:四川省绵阳中学2010-2011学年高一下学期第一次月考化学试题 题型:022
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.请推断后回答下列问题:
(1)写出:W的原子结构示意图________,R离子的电子式________,Y在周期表中的位置________.
(2)X、Y、Z三种元素形成的化合物属于________化合物(填“离子”或“共价”),其电子式为________.
(3)Z在Y单质中燃烧的产物电子式为________,其中含有的化学键类型为________.
(4)Y、Z、W、R形成的简单离子半径由大到小顺序为________.
(5)W单质与Z的高价氧化物对应的水化物反应的离子方程式为________.
查看答案和解析>>
科目: 来源:安徽省望江县2010-2011学年高一上学期期末联考化学试题 题型:022
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
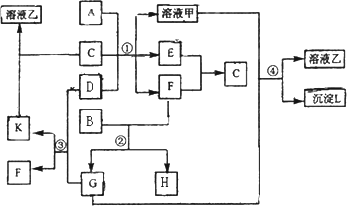
(1)A、B、C、D代表的物质分别为________、________、________、________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、________(填化学式);
(4)反应③产物中K的化学式为________;
(5)反应④的离子方程式为________.
查看答案和解析>>
科目: 来源:江苏省仪征中学2010-2011学年高二上学期期末统考化学试题(选修) 题型:022
DAP-A树脂是一种优良的热固性树脂,被用作高级UV油墨的一种成分.用UV油墨印刷的优点是:印刷时油墨极快干燥;对环境及人员无损害;性价比较高.因此,适于大规模生产食品、酒类、洗条剂等包装纸盒.这种材料可采用下列合成路线:
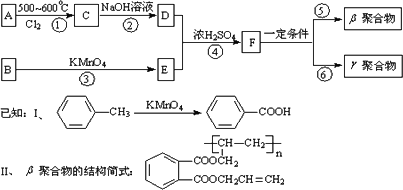
试回答下列问题:
(1)在①~④的反应中属取代反应的是________.
(2)写出反应②的化学方式________
(3)写出反应⑤的化学方程式________
(4)工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是________和________.
查看答案和解析>>
科目: 来源:黑龙江省哈九中2010-2011学年高二上学期期末考试化学试题 题型:022
已知H2B为二元弱酸,请回答下列问题:
(1)①Na2B溶液呈________(填
“酸性”、“碱性”或“中性”)②若升高Na2B溶液的温度,则c(HB
-)和c(B2-)比值将________(填“增大”、“减小”或“不变”)(2)某温度下,在0.1 mol/L的NaHB溶液中,以下关系一定不正确的是________.
A.C(H+)·C(OH-)=1×10-14
B.pH>7
C.C(OH-)=2C(H2B)+C(HB-)+C(H+)
D.C(HB-)<0.1 mol/L
(3)某温度下,FeB在水中的沉淀溶解平衡曲线如下图所示.
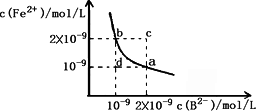
①写出FeB在水中的沉淀溶解平衡的方程式:________.
②该温度下,将FeB固体加入水中,得到的悬浊液中c(Fe2+)为:________mol/L(保留小数点后1位).
③根据图像,下列说法正确的是:________.
A.a点对应的Ksp等于b点对应的Ksp
B.通过蒸发可以使溶液由c点变到a点
C.d点无FeB沉淀生成
D.若改变条件,使FeB的溶解度发生变化,则FeB的Ksp也一定会发生变化
查看答案和解析>>
科目: 来源:辽宁省营口市2010-2011学年高二上学期期末检测化学试题 题型:022
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).

已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子的浓度由大到小的顺序为:________.
(2)写出E溶液与过量的B溶液反应的离子方程式________.
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);ΔH=-a kJ·mol-1.请写出B与C的稀溶液反应的热化学方程式________.
(4)在100 mL 0.1 mol·L-1 E溶液中,逐滴加入35 mL 2 mol·L-1 NaOH溶液,最终得到沉淀物质的量为________.
查看答案和解析>>
科目: 来源:辽宁省营口市2010-2011学年高二上学期期末检测化学试题 题型:022
现有浓度均为0.1 mol/L的下列溶液:
①硫酸
②醋酸
③氢氧化钠
④氯化铵
⑤醋酸铵
⑥硫酸铵
⑦硫酸氢铵
⑧氨水
请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________.
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是________.
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)________25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________
查看答案和解析>>
科目: 来源:江苏省东台市2010-2011学年高二上学期期未考试化学试题 题型:022
(1)CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是________.
A.它们均由甲烷去掉一个氢原子所得
B.它们
互为等电子体,碳原子均采取sp2杂化C.CH3-
与NH3、H3O+互为等电子体,几何构型均为三角锥形D.CH3+
中的碳原子采取sp2杂化,所有原子均共面E.
两个CH3-或一个CH3+和一个CH3-结合均可得到CH3CH3(2)
锌是一种重要的金属,锌及其化合物有着广泛的应用.①指出锌在周期表中的位置:第________周期,第________族,属于________区.
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式________;葡萄糖分子中碳原子杂化方式有________.
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键.

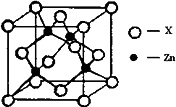
④下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为________;该化合物晶体的熔点比干冰________(填写“高”或“低”),原因是________.
查看答案和解析>>
科目: 来源:江苏省东台市2010-2011学年高二上学期期未考试化学试题 题型:022
(一)下列是A、B、C、D、E五种短周期元素的某些些性质

(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是________
A.![]()
B.CH4
C.CH2=CHCH3
D.CH3CH2C≡CH
E.CH3CH3
(2)与AD2互为等电子体的分子、离子的化学式依次为________、________(各写1种)
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是________(写分子式),理由是________;
(二)下列是部分金属元素的电离能
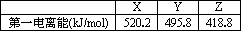
(4)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为________.
(5)CuCl用作有机合成催化剂,并用于颜料,防腐等工业.CuCl的晶体结构如图所示.元素Cu基态原子的电子排布式________,与同一个Cl-相连的Cu+有________个.

查看答案和解析>>
科目: 来源:宁夏银川一中2010-2011学年高二上学期期末考试化学试题 题型:022
吉非罗齐是一种降血脂药物,有人以A、B为初始物质,设计了如下合成路线,其中A是一种芳香烃.

已知:
![]()
请回答:
(1)A的名称是________.
(2)下列关于F的化学性质的说法中正确的是________(填选项字母).
a.与浓硫酸共热可以发生消去反应
b.与小苏打溶液反应可放出气体
c.与NaOH溶液反应时,1 mol F最多可消耗2 mol NaOH
(3)反应④的反应类型是________.
(4)E有多种同分异构体,其中分子结构中含有“-CH2-CH2-CH2-OH”和“-COOH”结构的同分异构体有________种(不包括E本身),请任写其中两种物质的结构简式:________.
(5)完成下列化学方程式:
反应①________
反应④________
查看答案和解析>>
科目: 来源:山东省济南外国语学校2010-2011学年高一下学期入学检测化学试题 题型:022
实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O试回答下列问题:
Cl2↑+MnCl2+2H2O试回答下列问题:
(1)该反应中________是氧化剂,氧化剂和还原剂的物质的量之比为________.写出该反应的离子方程式________.
(2)若用下图装置收集氯气,气体应从________口进入.

(3)氯气有毒、且氯气溶入水显酸性,请写出氯气溶于水的离子方程式________,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境.实验室中可采用NaOH溶液来吸收有毒的氯气,化学方程式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com