
科目: 来源:江西省高安中学2010-2011学年高二下学期期中考试化学试题 题型:022
请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比例k(质量比)生成的产品.理论上k=________(要求写出计算表达式和结果).
(2)原料粗盐中常含有泥沙和Ca2+,Mg2+,Fe3+,SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水中过滤后,还要加入的试剂分别为①Na2CO3,②HCl(盐酸),③BaCl2,这3种试剂添加的合理顺序是________(填序号).
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
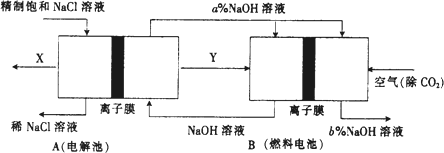
①图中X,Y分别是________,________(填化学式),分析并比较图中氢氧化钠质量分数a%与b%的大小________.
②分别写出燃料电池B中正极、负极上发生的电极反应.正极:________.
负极:________.
③这样设计的主要节(电)能之处在于(写出2处):________、________.
查看答案和解析>>
科目: 来源:江西省高安中学2010-2011学年高二下学期期中考试化学试题 题型:022
从铝土矿(主要成分是Al2O3,含SiO2,Fe2O3,MgO等杂质)中提取两种工艺品的流程如下图所示:
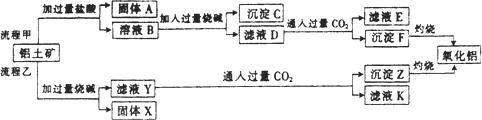
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为________.
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________.
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称).
(4)滤液E,K中溶质的主要成分是________(填化学式),写出该溶液的一种用途________.
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=________.
查看答案和解析>>
科目: 来源:江苏省盐城中学2010-2011学年高二下学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省泰州中学2010-2011学年高二下学期期中考试化学试题 题型:022
Ⅰ.下图为向25 mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:
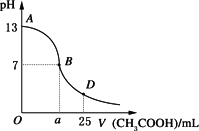
(1)B点溶液呈中性,此时a________12.5(填“>”、“<”或“=”).有人据此认为,在B点时NaOH与CH3COOH恰好完全中和,这种看法是否正确?________(选填“是”或“否”).若不正确,则二者恰好完全中和的点是在AB区间还是BD区间内?________区间(若正确,此问不答).
(2)关于该滴定实验,从下列选项中选出最恰当的一项________.(选填字母)
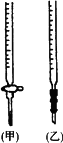

滴定终点时的现象为:________
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是________
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)________2c(Na+).(填“>”、“<”或“=”)
Ⅱ.酸碱中和滴定实验是中学阶段重要的定量实验之一.根据所学内容,试回答下列问题:
(5)滴定管精确度较高,可读至________mL.准确量取KMnO4溶液可用________式滴定管.
(6)滴定时其余操作均准确,若用待测液润洗锥形瓶,则测得待测液的浓度________(填偏高、偏低、不变.下同);若盛放标准液的滴定管下端有气泡,且在滴定过程中排出,则测得待测液的浓度________
查看答案和解析>>
科目: 来源:江苏省泰州中学2010-2011学年高二下学期期中考试化学试题 题型:022
(1)在温度t℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L,则该温度下水的离子积Kw=________,t________25℃(填“>”、“<”或“=”),在此温度下pH均为4的硫酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为________.
该温度下,将100 mL 0.1 mol·L-1的稀H2SO4与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=________.
(2)将标准状况下的4.48 L氨气完全溶解在含0.05 mol H2SO4的水溶液中形成1 L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序________.无论氨水与硫酸以何种比例混合,溶液中始终存在的等量关系是c(NH![]() )+c(H+)=________.
)+c(H+)=________.
(3)常温下,pH=10的强碱AOH和1×10-4 mol/L的三元酸H3B等体积混合后溶液显酸性,生成盐的化学式为________.若AOH与H3B完全中和所得正盐溶液呈碱性,其原因用离子方程式表示为________.
查看答案和解析>>
科目: 来源:江苏省无锡一中2010-2011学年高二下学期期中考试化学试题 题型:022
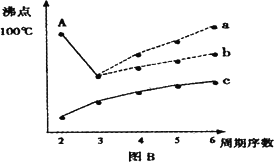
(1)短周期某主族元素M的电离能情况如图A所示.则M元素位于周期表的第________族.

(2)下图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:________,理由是:________.
(3)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti).钛被誉为“未来世纪的金属”.试回答下列问题:
①22Ti元素基态原子的价电子层排布式为________.
②金属钛的堆积方式是________.
③钛合金,密度小、比强度高、耐腐蚀性强,用于涡轮发动机和飞机构架,其缺点是在一定条件下会燃烧,目前阻燃钛合金是工程实用化的主攻方向.钛合金在物质分类中属于________(填“混合物”或“化合物”).
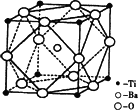
④在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如下图,则它的化学式是________.
查看答案和解析>>
科目: 来源:江苏省无锡一中2010-2011学年高二下学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省无锡一中2010-2011学年高一下学期期中考试化学试题 题型:022
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是________(填名称),W在周期表中的位置________.
(2)X与Y形成化合物的电子式为________,X与W组成的化合物中存在________键(填“离子”“共价”).
(3)①写出实验室制备YX3的化学方程式:________,②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2
mol YX3气体时放出92.4 kJ的热量,写出该反应的热化学方程式________(4)由X、Y、Z、W四种元素组成的一种离子化合物A
已知
1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8 L气体.则A的名称是________.(5)由
X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6 mol结晶水.对化合物B进行如下实验:a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
则B的化学式为________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2010-2011学年高一下学期期中考试化学试题 题型:022
元素周期表是学习物质结构与性质的重要工具.下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素.请用所给元素回答下列问题.
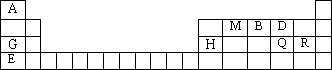
(1)Q元素在元素周期表中的位置________,E元素原子结构示意图为________
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)________.
(3)M、D两元素形成的化合物中含有的化学键类型是________,其MD2分子的结构式:________.
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:________;元素G、H的金属性强弱:________.
查看答案和解析>>
科目: 来源:广西南宁沛鸿民族中学2010-2011学年高二下学期期中考试化学理科试题 题型:022
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
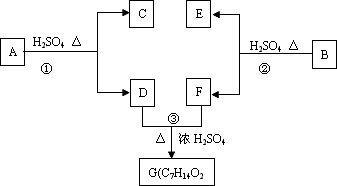
(1)化合物C的分子式是C7H8O,C遇FeCl3溶液显紫色,核磁共振氢谱表明C分子中有4种不同化学环境的氢,则C的结构简式为________.
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为________,D具有的官能团名称是________.
(3)反应①的化学方程式是________.
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是________.
(5)E可能的结构简式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com