
科目: 来源:山东省邹城一中2010-2011学年高二下学期期末考试化学试题 题型:022
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)![]() CH3OH(g);ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K).
CH3OH(g);ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K).

①根据表中数据可判断ΔH________0(填“>”、“=”或“<”).
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1 L的密闭容器中,此时反应将________.
A.向正方向移动
B.向逆方向移动
C.处于平衡状态
D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1451.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);
ΔH=-566.0 kJ·mol-1写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________.
(3)
以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为
________;如果电解一段时间后NaCl溶液的体积为1 L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为________mL(标况下).查看答案和解析>>
科目: 来源:山东省邹城一中2010-2011学年高二下学期期末考试化学试题 题型:022
CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸________醋酸(填“>”、“=”或“<”).
(2)将100 mL 0.1 mol·L-1的CH3COOH溶液与50 mL 0.2 mol·L-1的NaOH溶液混合,所得溶液呈________性,原因________(用离子方程式表示).
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),则该溶液中含有的溶质为________.
(4)已知Ka(CH3COOH)=1.76×10-5,Ka(HNO2)=4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者________后者(填“>,<或=”)
(5)已知25℃时,0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由________.
查看答案和解析>>
科目: 来源:海南省海南中学2010-2011学年高一下学期期末考试化学试题(1班) 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:海南省海南中学2010-2011学年高一下学期期末考试化学试题(1班) 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:海南省海南中学2010-2011学年高一下学期期末考试化学试题(1班) 题型:022
甲元素的原子序数是9,乙是元素周期表第三周期中金属性最强的元素,丙元素原子核外有三个电子层,最外层电子层上有6个电子,丁元素比丙多一个质子,由此推断:
(1)甲元素在周期表中位于第二周期的________族
(2)甲元素的气态氢化物的稳定性比HCl的________(填“强”或“弱”)
(3)乙元素单质在空气中燃烧,生成一种淡黄色的固体的名称是________,指出它所含的化学键的类型________.
(4)乙元素原子半径比丙元素原子________(填大或小)
(5)丙元素最高价氧化物的水化物的分子式是________,它的酸性比磷酸的________(填“强”或“弱”)
(6)另有A,B,C三种短周期元素,A和B同周期,A和C同主族,三者的原子序数之和为41,三者的最外层电子总数为19,则推断出的元素依次为A________B________C________.(填元素符号)
查看答案和解析>>
科目: 来源:山东省济南市重点中学2010-2011学年高二下学期期末考试化学试题 题型:022
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e- ΔH=+284 kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s) ΔH=+396 kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g) ΔH=-1200 kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式________.
(2)有效地开发利用CO2可以降低大气中CO2的含量,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)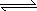 CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率
v(H2)=________mol/(L·min);②CO2的转化率=________;
③该反应的平衡常数为________(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目: 来源:山东省济南市重点中学2010-2011学年高二下学期期末考试化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:学习高手选修化学(反应原理人教版) 人教版 题型:022
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)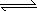 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=________.
(2)降低温度,该反应K值________,二氧化硫转化率________,化学反应速率________.(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________.
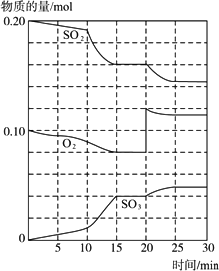
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号).
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3的物质的量
查看答案和解析>>
科目: 来源:选修高手化学苏教·有机化学基础 苏教版 题型:022
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物.已知:

(1)写出C的结构简式________.
(2)写出反应②的化学方程式________.
(3)写出G的结构简式________.
(4)写出反应⑧的化学方程式________.
(5)写出反应类型:④________,⑦________.
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是________.
A.三氯化铁溶液
B.碳酸氢钠溶液
C.石蕊试液
查看答案和解析>>
科目: 来源:选修高手化学苏教·有机化学基础 苏教版 题型:022
苏丹红一号(sudan Ⅰ)是一种偶氮染料,不能作为食品添加剂使用.它是由苯胺和2萘酚为主要原料制备的,它们的结构简式如下所示:
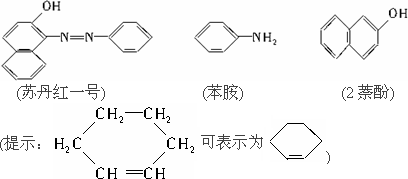
(1)苏丹红一号的化学式(分子式)为________.
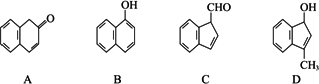
(2)在下面化合物A~D中,与2萘酚互为同分异构体的有(填字母代号)________.
(3)上述化合物C含有的官能团是________.
(4)在适当的条件下,2萘酚经反应可得到芳香化合物E(C8H6O4),1 mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8 L(标准状况),E与溴在有催化剂存在时反应只能生成两种一溴代物,两种一溴代物的结构简式分别是________,E与碳酸氢钠反应的化学方程式是________.
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是________,反应类型是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com