
科目: 来源:河南省许昌四校2011-2012学年高二第一次联考化学试题 题型:022
己知:
(1)2C(石墨s)+O2(g)=2CO(g) ΔH=-222 KJ/mol
(2)2H2(g)+O2(g)=2H2O(g) ΔH=-484 KJ/mol
(3)C(石墨s)+O2(g)=CO2(g) ΔH=-393.5 KJ/mol
(4)H2O(g)=H2O(L) ΔH=-44 KJ/mol
(5)C(金刚石s)+O2(g)=CO2(g) ΔH=-395.4 KJ/mol
回答下列问题:
(1)C(石墨)的燃烧热为________.
(2)写出表示H2的燃烧热的热化学方程式:________.
(3)写出石墨转化为金刚石的热化学方程式(可不注明条件)________.相对更稳定的物质是________.
(4)工业上制H2的一个重要反应是:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
①该反应的ΔH=________.
②为了提高CO的转化率,下列措施可采用的是________.
A.升高温度
B.增大压强
C.选择合适的催化剂
D.增大H2O(g)的浓度
③平衡常数K的表达式:K=________.
④800℃时,该反应的平衡常数K=1,则850℃时K________1(填.>、<、=)
⑤800℃时,若起始浓度:C(CO)=1 mol/L,C(H2O)=4 mol/L,则达平衡时,C(H2)=________,CO的转化率为________.
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第三次月考化学试题 题型:022
已知:
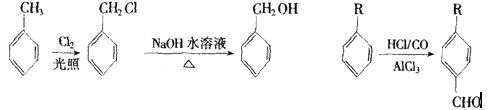
从A出发可发生下图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,
当以铁作催化剂进行氯化时,一元取代物只有两种.
请填空:
(1)结构简式:A_________,M_________.
(2)反应类型:III_________,Ⅳ_________.
(3)写出下列反应的化学方程式:
C+D→H_________.F→G_________.
(4)与C互为同分异构体且均属于酯类的芳香族的化合物共有_________种
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第三次月考化学试题 题型:022
化学-选修物质结构与性质
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分别属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M常作为耐火材料.请回答下列问题:
(1)W原子L层电子排布式为_________,W3空间构形是_________.
(2)X单质与水反应的主要化学方程式_________.
(3)化合物M的化学式_________,将一定是的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯.在碳酸二甲酯分子中,碳原子采用的杂化方式有_________,O-C-O的键角约_________.
(4)X、Y、Z可形成立方晶体的化合物,其晶胞中X占有棱的中心,Y位于顶角,Z位于体心位置,则该晶体的组成为X∶Y∶Z=_________.
(5)含有元素Z的盐的焰色反应为_________色,许多金属盐都可以发生焰色反应,其原因是_________.
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第三次月考化学试题 题型:022
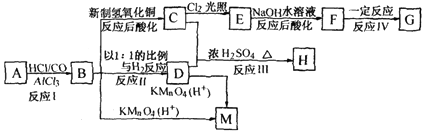
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去).

(1)写出下列物质的化学式:D_________;X_________;
(2)在反应①~⑦中,不属于氧化还原反应的是_________(填编号).
(3)反应⑥的离子方程式为:_________
(4)往G溶液中加入NaOH溶液观察到的现象是
(5)反应⑦的化学方程式为_________;
该反应中每消耗0.3 mol的A,可转移电子_________mol.
(6)写出D的溶液与小苏打溶液反应的离子方程式为_________.
查看答案和解析>>
科目: 来源:江苏省江阴市一中2011-2012学年高二上学期期中考试化学(选修)试题 题型:022
由环己烷可制得1,4-环己二醇,下列有7步反应(其中无机产物都已略去),试回答:
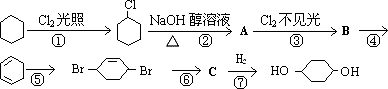
(1)反应________属于取代反应(填序号),反应⑦的反应类型________.
(2)化合物的结构简式:B________,C________;
(3)反应④所用试剂和条件是________;
(4)写出反应②、⑤的化学方程式:
反应②________
反应⑤________
查看答案和解析>>
科目: 来源:江苏省江阴市一中2011-2012学年高二上学期期中考试化学(选修)试题 题型:022
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:安徽省蚌埠二中2011-2012学年高二第一次质检化学试题 题型:022
已知:R-CH2-X![]() R-CH2-OH,根据下列流程回答:
R-CH2-OH,根据下列流程回答:
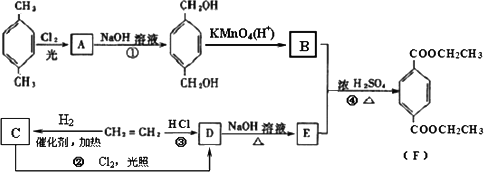
(1)写出结构简式A________,E________.
(2)反应①的反应类型是________,B分子中含有的官能团有________.
(3)请写出化学方程式:B+E→F________.
查看答案和解析>>
科目: 来源:安徽省蚌埠二中2011-2012学年高二第一次质检化学试题 题型:022
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是________;
(3)实验室中现有NaSO4、MgSO4、Ag2SO4、K2SO4等4中溶液,可与实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.

①请完成此实验设计,其中:V1=________,V9=________;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因________.
查看答案和解析>>
科目: 来源:浙江省效实中学2010-2011学年高一下学期期末考试化学试题 题型:022
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图.
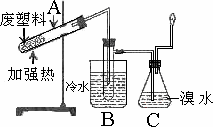
加热聚丙烯废塑料得到的产物如下表:

(1)试管A中残余物有多种用途,如下列转化就可可制取聚物聚乙炔
![]()
写出反应②的化学方程式.________
(2)试管B收集到的产品中,其中有一种物质M能使酸性高锰酸钾溶液褪色
①试写出体现该物质重要用途的一个反应方程式________;
②如该物质发生一氯取代,则生成物的同分异构体共有有________种;
③另有M的同系物,分子式为C10Hn,则n=________,该物质结构中有2个乙基,则其所有可能的结构简式为________
(3)锥形瓶C中观察到的现象________经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为________
(4)写出C中逸出的气体在工业上的两种用途________、________.
查看答案和解析>>
科目: 来源:江西省安福中学2011-2012学年高二上学期第一次月考化学试题 题型:022
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g).某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.根据图示回答下列问题:
2SO3(g).某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.根据图示回答下列问题:

①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa.该反应的平衡常数等于________.
②平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”).
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g);
2N2(g)+CO2(g)+2H2O(g);
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数的值用NA表示),放出的热量为________kJ.
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去.转化流程如图所示:

请写出MFe2Ox分解SO2生成MFe2O4的化学方程式________(不必配平).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com