
科目: 来源:山东济宁微山一中2012届高三上学期第二次质量检测化学试题 题型:022
A、B、C均为中学化学常见的单质,其中一种是金属,通常状况下,A为固体,B为黄绿色气体,C为气体,其余均为化合物,X是一种常用的具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去).
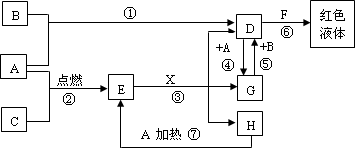
(1)写出:A的化学式________,F的化学式________.
(2)在反应①~⑦中,不属于氧化还原反应的是________(填序号).
(3)完成:E和X反应的离子方程式:________;
(4)完成H和某种化合物快速制C的化学方程式________,每生成0.15 mol C电子转移________mol.
(5)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:________.
查看答案和解析>>
科目: 来源:内蒙古呼伦贝尔市牙克石林业一中2012届高三第二次模拟考试化学试题 题型:022
X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
(1)化合物YX3的空间构型为________;X原子的杂化轨道类型为________.
(2)XW的电子式是________.
(3)XW与YX3反应生成一种盐,该盐水溶液的pH________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)________.
(4)Z元素氢化物的沸点比H2O________(填“低”或“高”).Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式________.
(5)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0.将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的是________.
a.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.到达化学平衡后,升高温度,YX3的体积分数增大
查看答案和解析>>
科目: 来源:内蒙古呼伦贝尔市牙克石林业一中2012届高三第二次模拟考试化学试题 题型:022
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________;X原子的杂化轨道类型为________
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低顺序为________.
查看答案和解析>>
科目: 来源:内蒙古呼伦贝尔市牙克石林业一中2012届高三第二次模拟考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省三明一中2012届高三11月学段考试化学试题 题型:022
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
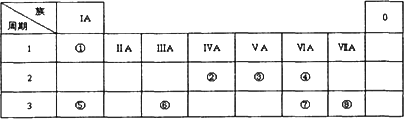
Ⅰ.(1)请画出元素⑧的离子结构示意图________.
(2)元素⑦中质子数和中子数相等的同位素符号是________.
(3)④、⑤、⑦的原子半径由大到小的顺序为________.(用半径符号表示)
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为________>________.
Ⅱ.由表中①-⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
![]()
(1)若X是强氧性化单质,则A不可能是________(填序号).
a.S
b.N2
c.C
d.Al
(2)若A是饮食中的有机物,B与C分子量相差16则A与C反应的方程式:并指出反应类型________
(3)若A,B、C为含有同一非金属元素的非电解质,写出符合上述关系A转化为B的化学方程式:________
查看答案和解析>>
科目: 来源:广东省普宁二中2011-2012学年高二11月月考化学试题 题型:022
常温下,有0.1 mol/L的盐酸和0.1 mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH,盐酸________(填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式________.
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈________(填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)________.
③向醋酸溶液中加入一定量的
NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为________(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为________a.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
b.c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
c.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
d.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源:陕西省师大附中2012届高三上学期期中考试化学试题 题型:022
物质A-L之间的转化关系如图,部分反应物和生成物及反应条件已省略.化合物A是由三种元素组成的一种矿石的主要成分.A在氧气中高温煅烧生成B、C、D、B为砖红色固体,D、I均为红色固体,E、I、K是三种常见金属,其中组成E的元素是地壳中含量最高的金属元素.L可作净水剂,向L溶液中加入BaCl2溶液,会生成不溶于稀硝酸的白色沉淀,H溶液呈蓝色.
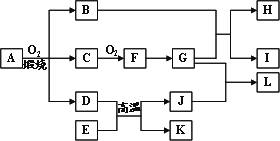
请回答下列问题:
(1)写出E和G的化学式:E________、G________.
(2)L可用作净水剂的原因是________(用离子方程式表示).
(3)写出B和G反应的化学方程式________.
(4)D+E→K+J的反应中放出大量的热,这类反应被称为________反应,举出这类反应的一个应用实例:________.
(5)A的相对分子质量为184,A与O2反应得到B、C、D三种物质的物质的量之比为1∶4∶1,某种检验葡萄糖的反应中含有B生成,则A的化学式为________.
(6)过量的I与含n mol G的浓G溶液共热生成m mol C,若给反应后的溶液中加入足量的K的粉末,则溶解掉K的质量为________g(用含n和m的代数式表示).
查看答案和解析>>
科目: 来源:辽宁省沈阳四校协作体2011-2012学年高二上学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省南安一中2011-2012学年高一上学期期中考试化学试题 题型:022
氢氧燃料电池是符合绿色化学理念的新型发电装置.
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
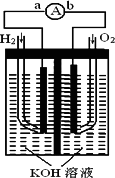
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________(用a、b表示).
(2)负极反应式为________.
(3)电极表面镀铂粉的原因为________.
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2Ⅱ.LiH+H2O![]() LiOH+H2↑
LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________.
②已知LiH固体密度约为0.8 g/cm3.用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________.
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol.
查看答案和解析>>
科目: 来源:江苏省盐城中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com