
科目: 来源:江苏省某重点中学2012届高三上学期11月练习化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省无锡市洛社中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:022
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶.制备它的一种配方中含有下列四种物质:
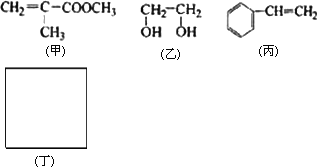
填写下列空白:
(1)甲中不含氧原子的官能团是________;下列试剂能与甲反应而褪色的是________(填标号)
a.Br2/CCl4溶液
b.石蕊溶液
c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:________.
(3)淀粉通过下列转化可以得到乙(其中A-D均为有机物):
淀粉![]() A
A![]() B
B![]() C
C![]() D
D![]() 乙
乙
A的分子式是________,试剂X可以是________.
(4)已知:

利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________.
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110.丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种.则丁的结构简式为________.
查看答案和解析>>
科目: 来源:江苏省无锡市洛社中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:022
高分子材料M在光聚合物和金属涂料方面有重要用途.
已知①磷酸的结构式为: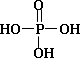
②M的结构为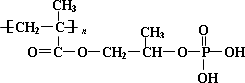
M可以用丙烯为原料,通过如下图所示的路线合成:
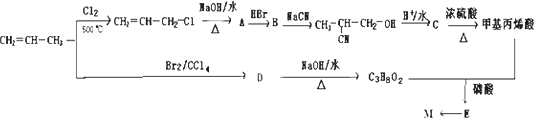
回答下列问题:
(1)写出E中两种官能团名称________和________.
(2)C→甲基丙烯酸的反应类型为________.
(3)符合下列条件的甲基丙烯酸的链状同分异构体数目为________(含甲基丙烯酸).
①能与溴水反应褪色;②与Na2CO3溶液反应放出CO2气体
(4)A→B的反应中还可能生成一种有机副产物,该副产物的结构简式为________.
(5)写出由D生成丙炔的反应条件________.
(6)请用反应流程图表示A→丙烯酸的合成线路,并注明反应条件________(提示:氧化羟基的条件足以氧化C=C).
例:由乙醇合成聚乙烯的反应流程图可表示为:
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目: 来源:广东省汕头市金山中学2011-2012学年高二上学期12月月考化学试题 题型:022
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:
(1)写出酸H2A的电离方程式________.
(2)Na2A的水溶液呈________性,原因是(用离子方程式表示):________往Na2A溶液中加入________可抑制其水解
A.NaOH固体
B.氯化铁固体
C.水
D.碳酸钠固体
已知K sp(BaA)=1.8×10-10,往20 mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为________mol·L-1.(忽略A2-的水解)
(3)若溶液M由2 mol·L-1 H2A溶液与2 mol·L-1 NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为________.
(4)若溶液M由下列三种情况:
①0.01 mol·L-1的H2A溶液;
②0.01 mol·L-1的NaHA溶液;
③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为________.
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为________(填“大于”“等于”“小于”或“均有可能”).
查看答案和解析>>
科目: 来源:广东省中山一中2012届高三上学期第三次统测化学试题 题型:022
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应________.(填字母)
A.所需的活化能很高
B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g)
2NO(g)
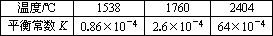
①该反应的ΔH________0.(填“>”、“=”或“<”)
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.

(3)
一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是________.A.降低温度
B.加催化剂
C.增加压强
D.增加O2浓度
E.分离出一氧化氮
(4)2404℃
时,在容积为1.0 L的密闭容器中通入2.6 mol N2和2.6 mol O2,计算反应N2(g)+O2(g)(5)
NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).且:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH=-534 kJ/mol
N2(g)+2H2O(g) ΔH=-534 kJ/mol
请写出肼与NO2反应的热化学方程式________.
查看答案和解析>>
科目: 来源:广东省中山一中2012届高三上学期第三次统测化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省临沂市卧龙学校2011-2012学年高二上学期期中模块检测化学试题 题型:022
在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:

(1)写出该反应的平衡常数表达式:K=________,
已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”);
(2)下图中表示NO2的变化的曲线是________,用O2的浓度变化表示从0~2 s内该反应的平均速率v=________;
(3)能说明该反应已经达到平衡状态的是________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
(5)若将容器体积缩小至1 L,反应达到平衡时的平衡常数________(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目: 来源:浙江省杭州师大附中2011-2012学年高二上学期期中考试化学试题 题型:022
研究表明,火灾中绝大多数人的第一死因并非高温烘烤或火烧,而是慌乱奔跑时吸入烟雾中毒.聚氯乙烯(PVC)是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:
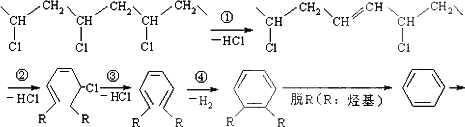
请回答下列问题:
(1)火灾中由聚氯乙烯产生的有害气体,其化学成分主要是________,你认为其中含量最大的为________,在火灾现场,为防止气体中毒的防护措施是________;
(2)工业上用乙烯和氯气为原料经下列各步合成PVC:
![]()
反应①、
②的化学方程式分别为①________、
②
________.(3)聚氯乙烯(PVC)可以制成保鲜膜.PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA.邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐 跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:
跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:
________.
查看答案和解析>>
科目: 来源:山东省日照一中2011-2012学年高二上学期期中考试化学(理)试题 题型:022
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH).“绿色自由”构想技术流程如下:
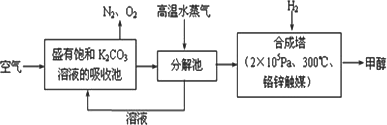
(1)在合成塔中,若有2.2 kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5 kJ的热量,试写出合成塔中发生反应的热化学方程式________.
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是________.
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是________.(填字母代号)
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(3)甲醇可制作燃料电池.写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________.当电子转移的物质的量为________时,参加反应的氧气的体积是6.72 L(标准状况下).
查看答案和解析>>
科目: 来源:河北省正定中学2011届高三上学期11月月考化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com