
科目: 来源:上海市崇明中学2012届高三上学期期中考试化学试题 题型:022
写出符合下列要求的有机物的结构简式:
(1)燃烧后生成CO2和H2O的物质的量之比为2的两种常见的烃:________,________;一种常见的烃的含氧衍生物:________.
(2)燃烧后生成H2O和CO2的物质的量之比为2的一种常见的烃:________.
(3)不能脱水生成烯烃的碳原子数小于6的两种饱和一元醇:________,________.
(4)氧化后生成乙酸的醛:________;加成后生成乙二醇的醛:________.
(5)[CH2-O]n的单体:________;丙烯聚合后的高分子:________.
查看答案和解析>>
科目: 来源:上海市崇明中学2011-2012学年高二上学期期中考试化学试题 题型:022
四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.

(1)写出元素T的离子结构示意图________;写出元素X的气态氢化物的电子式________.
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式________.
(3)Z的最高价氧化物对应水化物的电离方程式________.
(4)元素T与氟元素相比,非金属性较强的是________(写元素符号),下列能证明该事实的是________.
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
查看答案和解析>>
科目: 来源:浙江省嘉兴市一中2010-2011学年高二3月月考化学试题 题型:022
如图所示将4 mol SO2和2 mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0.该反应达到平衡状态A时,测得气体总物质的量为4.2 mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
2SO3(g) ΔH<0.该反应达到平衡状态A时,测得气体总物质的量为4.2 mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数________(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:________或________.
(2)若起始时a=1.2 mol,b=0.6 mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为________.
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是________.
查看答案和解析>>
科目: 来源:山东省潍坊市重点中学2011年新高一暑假作业(三)化学试题 题型:022
下表是A、B、C、D、E五种有机物的有关信息;
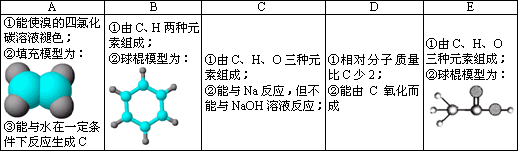
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应,其生成物的结构简式为________;写出在一定条件下,A生成高分子化合物的化学反应方程式________.
(2)A与氢气发生加成生成F,与F在分子组成和结构上相似的有机物有一大类,它们均符合通式CnH2n+2.当n=________时,这类有机物开始出现同分异构体.
(3)B具有的性质是________(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液或溴水反应而使它们褪色写出在浓硫酸作用下,B与浓硝酸反应的化学方程式________
(4)写出由C氧化生成D的化学反应方程式________.
(5)写出C与E发生反应的化学方程式________,其反应类型为________.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2010-2011学年高二下学期期末考试化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2010-2011学年高二下学期期末考试化学试题 题型:022
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:________.
(2)写出3p轨道上有2个未成对电子的元素的符号:________.
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4该元素的的名称是________.
(4)第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素.硼酸的结构式可表示为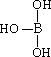 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:________.
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:________.
(5)已知:下列化学键的键能(KJ/mol),Si-O;460,Si-Si∶175,O=O∶498,则反应Si+O2=SiO2的反应的△H=________
(6)写出二氧化硫和水合氢离子中硫原子,氧原子分别采用________和________杂化形式,其空间构型分别为________和________.
(7)已知N-N,N=N,N≡N键能之比为1.00∶2.17∶4.90,而C-C,C=C,C≡C键能之比为1.00∶1.77∶2.34.用数据分析氮分子不容易发生加成反应而乙烯和乙炔容易发生加成反应的原因________.
(8)用氢键表示法表示邻羟基苯甲醛分子内氢键________.
查看答案和解析>>
科目: 来源:山东省兖州市2010-2011学年高一下学期期末考试化学试题 题型:022
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;

请完成下列填空:
(1)H的化学式________;其晶体中所含化学键类型为________;检验H中阳离子的方法是________.
(2)A与B在加热条件下反应的主要现象是________;F和H2O反应的化学方程式为________;写出G溶液中加入过量的I溶液反应的离子方程式________.
(3)某温度时,在2 L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为________.反应开始至2 min,用J表示的平均反应速率为________.
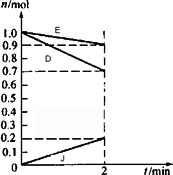
查看答案和解析>>
科目: 来源:河北省唐山一中2010-2011学年高二下学期期末考试化学试题 题型:022
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示:
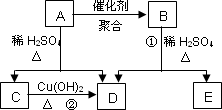
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO.
根据以上信息回答下列问题:
(1)A的分子式为________;
(2)反应②的化学方程式是________;
(3)A的结构简式是________;
(4)反应①的化学方程式是________;
(5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为________.
查看答案和解析>>
科目: 来源:山东省兖州市2010-2011学年高二下学期期末考试化学试题 题型:022
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;
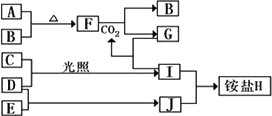
请完成下列填空:
(1)H的电子式________;检验H中阳离子的方法是________.
(2)A与B在加热条件下反应的主要现象是________;F晶体中所含化学键为________;F和H2O的化学方程式________;1 mol的F与足量的水反应转移电子物质的量为________.
(3)某温度时,在2 L容器中,D、E、J三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为________.反应开始至2 min,用J表示的平均反应速率为________.

查看答案和解析>>
科目: 来源:安徽省马鞍山市2010-2011学年高一下学期期末考试化学试题 题型:022
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
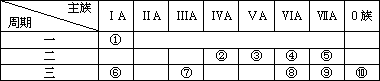
(1)在这些元素中,化学性质最不活泼的是:________(填元素符号).
(2)元素②和③非金属性较弱的是________(填元素符号),画出元素③原子结构示意图________.
(3)④和⑧气态氢化物的稳定性较强的是________(填化学式).
(4)在最高价氧化物的水化物中,酸性最强的化合物的分子式是________,碱性最强的化合物的电子式是________.
(5)用电子式表示元素①和⑤所形成化合物的形成过程:________.
(6)⑤⑥⑦三种元素分别形成的单核离子半径由大到小顺序为________(填离子符号).
(7)元素①和④按原子个数比1∶1形成的化合物分解的化学方程式________.
(8)写出元素⑦和⑨最高价氧化物的水化物之间反应的离子方程式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com