
科目: 来源:广东省广州六校2012届高三第二次联考化学试题 题型:022
已知HI是一种无色,有刺激性气味,极易溶于水的气体,HI的水溶液称之为氢碘酸,是一种强酸.
(1)请写出I元素在周期表的位置:第五周期________族
(2)将HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能有________气体.
(3)小明拟对HI通入浓硫酸后的混合气体成分进行验证和探究.他设计了如下实验装置图
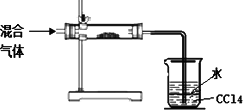
初步探究设计:
①其中直形玻璃管中所装的药品是________(写名称)
②足量四氯化碳的两个作用是:________.
进一步探究:
查阅资料:氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2.
③小明拟对溶在水层的其它混合气体成分做进一步探究.请你从以下限选试剂中选择合适的试剂帮小明完成实验报告.
限选的试剂:石蕊试剂、品红溶液、酸性KMnO4溶液、0.1 mol/L HNO3、淀粉溶液、BaCl2溶液

查看答案和解析>>
科目: 来源:广东省广州六校2012届高三第二次联考化学试题 题型:022
CoCl2·6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为________.
(2)加入碳酸钠调节pH至a,a的范围是________;
(3)操作Ⅰ包含3个基本实验操作,它们是________、________和过滤.
(4)制得的CoCl2·6H2O需减压烘干的原因是________.
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________(任写1点).
查看答案和解析>>
科目: 来源:广东省广州六校2012届高三第二次联考化学试题 题型:022
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度.目前,用活性炭还原法处理氮氧化物是消除氮氧化物污染的有效方法.
(1)已知产物A、B都是参与大气循环的气体,请结合下表数据写出NO与活性炭反应的化学方程式:________
(2)某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:

①T1℃时,求该反应平衡常数(列出K的表达式,要求计算过程).
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________.
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、A、B的浓度之比为5∶3∶3,则该反应的△H________0(填“>”、“=”或“<”).
④压缩容器体积,增大压强对该反应的反应速率和平衡移动的影响是________.
查看答案和解析>>
科目: 来源:山东省潍坊市三县2011-2012学年高二上学期模块学分认定检测化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:宁夏银川一中2011-2012学年高二上学期期中考试化学试题 题型:022
根据图示填空
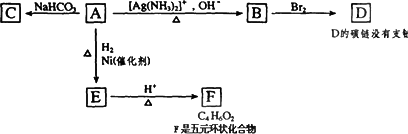
(1)化合物A中含氧官能团的名称是________.
(2)1 mol A与2 mol H2反应生成1 mol E,其反应方程式是________.
(3)B在酸性条件下与Br2反应得到D,D的结构简式是________.写出D与NaOH溶液反应的化学方程式________.
(4)F的结构简式是________.
查看答案和解析>>
科目: 来源:四川省成都市六校协作体2011-2012学年高二上学期期中考试化学试题 题型:022
材料(选修三课本第44页实验2-2):向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体.
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂.水是生命之源,它与我们的生活密切相关.
(1)写出与H2O分子互为等电子体的微粒________(填1种).
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是________.
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为________
(Ⅱ)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上.
(4)写出铜原子价电子层的电子排布式________,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有________(填元素符号).
(5)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:________;________.
实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有________.
(6)实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体.实验中所加C2H5OH的作用是________
查看答案和解析>>
科目: 来源:四川省成都市六校协作体2011-2012学年高二上学期期中考试化学试题 题型:022
下图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.回答下列问题:

(1)请在图中将过渡元素所在的位置“用斜线”画出.
(2)R的第一电离能________A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式________;
(3)R的氢化物在A的氢化物中溶解度极大,原因是________;
A的氢化物比B的氢化物热稳定性强,原因是________.
(4)图中A、B两元素形成的离子B2A![]() 中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是________,依据是________.
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是________,依据是________.
(5)第三周期8种元素按单质熔点(℃)高低的顺序如下图,(已知序号“1”代表Ar),其中序号“8”代表________(填元素符号);其中电负性最大的是________(填下图中的序号).

(6)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因________
查看答案和解析>>
科目: 来源:四川省成都市六校协作体2011-2012学年高二上学期期中考试化学试题 题型:022
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1∶1和1∶2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是________(填元素符号或化学式,下同);第一电离能从大到小的顺序是________
(2)C原子的电子排布图________,D2-的结构示意图________.A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________,分子中含有________键(填“极性”或“非极性”,下同)是________分子.
(3)A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式________,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为________杂化,空间构型为________.
(4)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为________,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为________.
查看答案和解析>>
科目: 来源:四川省成都市六校协作体2011-2012学年高二上学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:云南省建水一中2011-2012学年高二上学期期中考试试化学理科试题 题型:022
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,
其余为氧.A的相关反应如下图所示:

已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO.根据以上信息回答下列问题:
(1)A的分子式为________;
(2)反应②的化学方程式是________:
(3)A的结构简式是________;
(4)反应①的化学方程式是________.
(5)A有多种同分异构体,写出四个同时满足:
(ⅰ)能发生水解反应;
(ⅱ)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:________、________、________、________;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com