
科目: 来源:海南省琼海市2012年高考模拟测试(一)化学试题 题型:022
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是________,上述离子浓度大小顺序关系中正确的是(选填序号)________.
②若上述关系中C是正确的,则溶液中溶质的化学式是________.
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)________c(Cl-)
查看答案和解析>>
科目: 来源:河南省卫辉市第一中学2012届高三3月考试化学试题 题型:022
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为常见金属,且I与G的稀溶液不反应,只能与G的浓溶液在加热条件下反应;酸G是重要的化工产品和化工原料;H为良好的耐火材料(图中部分产物没有列出).
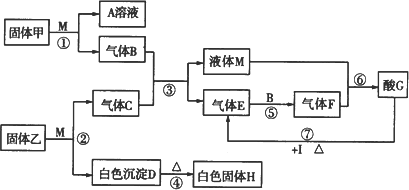
(1)固体甲的名称为________,F的化学式为________.
(2)反应①~⑦中属于氧化还原反应的是________(填写反应序号).
(3)工业废气中常含有气体E,为了充分利用资源、保护环境,目前应用最广泛的工业废气处理方法是石灰法.以生石灰为原料在吸收装置中与气体E反应的化学方程式为:________.
(4)反应⑦的化学反应方程式为________.
(5)已知工业上电解熔融的H冶炼金属单质X,向40.0 g固体混合物中(仅含H、Fe2O3、SiO2),加入足量稀盐酸,分离得到12.0 g固体;滤液中加入过量A溶液,分离得到21.4 g固体;则此混合物中元素X的质量分数为________.
查看答案和解析>>
科目: 来源:河南省卫辉市第一中学2012届高三3月考试化学试题 题型:022
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江西省德兴一中2011-2012学年高二下学期第一次月考化学试题 题型:022
含苯酚的工业废水处理的流程图如下图:

(1)上述流程里,设备Ⅰ中进行的是________操作(填写操作名称).实验室里这一步操作可以用________进行(填写仪器名称).
(2)由设备Ⅱ进入设备Ⅲ的物质A是________,由设备Ⅲ进入设备Ⅳ的物质B是________.
(3)在设备Ⅲ中发生反应的化学方程式为:________.(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________.通过________操作(填写操作名称),可以使产物相互分离.
(5)上图中,能循环使用的物质是C6H6、CaO、________、________.
查看答案和解析>>
科目: 来源:江西省德兴一中2011-2012学年高二下学期第一次月考化学试题 题型:022
已知(1)RNH2+![]() CH2Cl
CH2Cl![]() RNHCH2
RNHCH2![]() +HCl(R和R'代表烃基)
+HCl(R和R'代表烃基)
(2)苯的同系物能被高锰酸钾氧化,如:
(3)

化合物C是制取消炎灵(盐酸祛炎痛)的中间产物,其合成路线为:
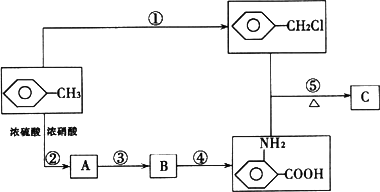
请回答下列问题:
(1)写出反应④的主要产物中含有官能团(除苯环外)的结构简式________.
(2)B物质的结构简式是________.
(3)反应①②的化学方程式
①________,②________.
(4)反应①~⑤中,属于取代反应的是(填反应序号)________.
查看答案和解析>>
科目: 来源:湖南省师大附中2011-2012学年度高二上学期期中考试化学试题(人教版) 题型:022
已知某溶液中只存在OH-、H+、NH![]() 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(Cl-)>c(NH![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号).
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________.
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)________c(OH-).
(4)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填图像符号)________;

查看答案和解析>>
科目: 来源:北京师大附中2011-2012学年高一上学期期末考试化学试题 题型:022
(1)实验室用氯化铵固体制取氨气的化学方程式是________.
(2)将4.48 L(标准状况)氨气通入水中得到0.05 L溶液,所得溶液的物质的量浓度是________.
(3)现有100 mL AlCl3与MgSO4的混合溶液,分成两等份.
①向其中一份中加入10 mL 4 mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是________.继续加入1 mol/L NaOH溶液至10 mL时,沉淀不再减少,沉淀减少的离子方程式是________,减少的沉淀的物质的量是________.
②向另一份中加入a mL 1 mol/L BaCl2溶液能使SO42-沉淀完全,a=________.
查看答案和解析>>
科目: 来源:北京市师大附中2011-2012学年高二上学期期中考试化学试题 题型:022
2010年美、日三位科学家因钯(Pd)催化的交叉偶联反应获诺贝尔化学奖.一种钯催化的交叉偶联反应如下:
(R、![]() 为烃基或其他基团)
为烃基或其他基团)
应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):

已知:①B能发生银镜反应,1 mol B最多与2 mol H2反应.
②C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与NaHCO3反应生成CO2,其消去产物的分子中只有一个碳原子上没有氢.
③G不能与NaOH溶液反应.
④核磁共振图谱显示J分子有3种不同的氢原子.
请回答:
(1)B中含有的官能团的名称________.
(2)B→D的反应类型________.
(3)D→E的化学方程式________.
(4)有机物的结构简式:G________;K________.
(5)符合下列条件的同分异构体有(包括顺反异构)________种,其中一种的结构简式是________.
a.与D互为同系物
b.相对分子质量是86
(6)分离提纯中间产物E的操作:先用碱除去D和H2SO4,再用水洗涤,弃去水层,最终通过________操作除去C8H17OH,精制得E.
查看答案和解析>>
科目: 来源:湖北省荆州中学2011-2012学年高二上学期期中考试化学试题(人教版) 题型:022
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)=3C(g)+D(s),已知将2 mol A和1 mol B充入该容器中,反应在某温度下达到平衡时,C的物质的量为W mol,C在平衡混合气体中的体积分数为n%.
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是________(选填序号).
A.体系压强不再变化
B.v正(A)=2v逆(B)
C.体系的密度不再变化
D.混合气体的平均相对分子质量不再变化
(2)如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:C的物质的量为2W mol,C在平衡混合气体中的体积分数仍为n%的是________
A.4 mol A+2 mol B
B.6 mol C+1 mol D
C.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
D.2 mol A+1 mol B+3 mol C+1 mol D
E.2 mol A+1 mol B+3 mol C+2 mol D
(3)若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为W mol,则D的起始物质的量n(D)应满足的条件是________(用含W的代数式表示)
(4)此反应的v-t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如乙图,请用“=、<、>”填空:a1________a2;两图中阴影部分面积:甲________乙.

查看答案和解析>>
科目: 来源:湖北省荆州中学2011-2012学年高二上学期期中考试化学试题(人教版) 题型:022
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K.工业上制备无水FeCl3的一种工艺如下:
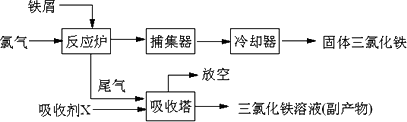
(1)试写出吸收塔中反应的离子方程式:________.
(2)已知六水合氯化铁在水中的溶解度如下:
从FeCl3溶液中获得FeCl3·6H2O的方法是:________.
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=________mol/L(已知:Ksp[Fe(OH)3]=1.1×10-36).
(4)FeCl3的质量分数通常可用碘量法测定:称取6克无水氯化铁样品,溶于稀盐酸,再转移到250 mL容量瓶,用蒸馏水定容;取出25 mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1 mol/L Na2S2O3溶液滴定用去V mL.
(已知:2Fe3++2I-=I2+2Fe2+ I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:________.
②滴定至终点,实验数据如下表所示:(第一次滴定终点的数据如下图中c点所示,请将你读得的数据填入表中)


则样品中氯化铁的质量分数为________(写出最终的计算结果).
③下列操作可能使测定结果偏低的是________.
A.滴定管在注入溶液前用蒸馏水洗后未用标准液润洗
B.开始时碱式滴定管尖嘴部分留有气泡,滴定过程中消失
C.盛FeCl3溶液的锥形瓶滴定前用FeCl3溶液润洗了2次
D.滴定前仰视滴定管读数,滴定后平视滴定管读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com