
科目: 来源:浙江省余姚中学2011-2012学年高二第一次质检化学试题 题型:022
莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一.莽草酸是A的一种同分异构体.A的结构简式如下:
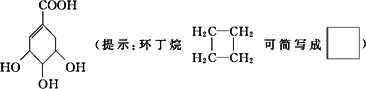
(1)A的分子式是________.
(2)A与溴的四氯化碳溶液反应的化学方程式是________
(3)A与氢氧化钠溶液反应的化学方程式是________.
(4)17.4 g A与足量碳酸氢钠溶液反应,则生成二氧化碳的体积(标准状况)为________L.
(5)A在浓硫酸作用下加热可得到B(B的结构简式为![]() ),其反应类型是________.
),其反应类型是________.
(6)B的同分异构体中既含有酚羟基又含有酯基的共有________种,写出其中一种同分异构体的结构简式________.
查看答案和解析>>
科目: 来源:黑龙江哈九中2011-2012学年度高二上学期期中考试化学试题(人教版) 题型:022
在一定条件下,存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=________
(2)升高温度,该反应K值________,SO2转化率________,正反应速率________(填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________
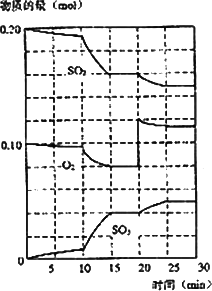
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达),10 min到15 min的曲线变化的原因可能是________(填编号).
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量
(5)在25℃下,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.
)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.
查看答案和解析>>
科目: 来源:陕西省长安一中2011-2012学年高二上学期期中考试化学试题(人教版) 题型:022
有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:

已知B的相对分子质量为60,分子中只含一个甲基.
C的结构可表示为: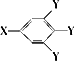 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团).
请回答下列问题:
(1)根据系统命名法,B的名称为________.
(2)官能团-X的名称为________;高聚物E的链节为________.
(3)A的结构简式为________.
(4)反应⑤的化学方程式为________.
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式________.
ⅰ.含有苯环
ⅱ.能发生银镜反应
ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是________(填序号).
a.含有苯环
b.含有羰基
c.含有酚羟基
查看答案和解析>>
科目: 来源:江苏省启东中学2011-2012学年高二上学期期中考试化学试题(选修) 题型:022
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2 s内的平均反应速率v(N2)=________.
②假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________.
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJ·mol-1.
SO3(g)+NO(g)的ΔH=________kJ·mol-1.
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应ΔH________0(填“>”或“<”).
CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应ΔH________0(填“>”或“<”).
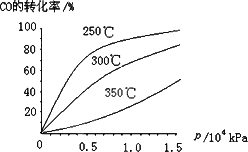
查看答案和解析>>
科目: 来源:广东省梅县东山中学2011-2012学年高二上学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江西省上高二中2011-2012学年高二第一次月考化学试题(实验班) 题型:022
现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”).
(2)减压时,A的质量分数_________.(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________.
(4)若升高温度,则平衡时B、C的浓度之比![]() 将_________.
将_________.
(5)若加入催化剂,平衡时气体混合物的总物质的量_________.
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_________;而维持容器内压强不变,充入氖气时,混合物颜色_________(填“变深”“变浅”或“不变”).
查看答案和解析>>
科目: 来源:陕西省师大附中2010-2011学年高一下学期期末考试化学试题 题型:022
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题
(1)E、G两种元素的符号:E________、G________;F在元素周期表中的位置是________.
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是________.
(3)E在D2中燃烧生成化合物X中阴阳离子个数比为________;X中的阴离子电子式为________.
(4)能够说明可逆反应2CD2(g)![]() C2D4(g)达到平衡状态的标志是________;
C2D4(g)达到平衡状态的标志是________;
①单位时间消耗2 mol CD2的同时,生成1 mol C2D4
②恒温恒压下,混合气体的密度不变
③CD2和C2D4的浓度之比为2∶1
④混合气体的颜色不变
⑤单位时间消耗4 mol CD2的同时,消耗2 mol C2D4
(5)向含E的最高价氧化物的水化物0.5 mol的水溶液中通入标况下BD2气体11.2 L,其化学反应方程式为________.
查看答案和解析>>
科目: 来源:浙江省杭州学军中学2010-2011学年高一下学期期中考试化学试题 题型:022
现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,已知A、D位于同一主族,A元素在元素周期表中原子半径最小,C是非金属性最强的元素,B、E原子最外层电子数相等,且B、E原子序数之和是A、D原子序数之和的两倍,F的最高价氧化物对应的水化物酸性最强.
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出B元素的元素符号,同时在图中将过渡元素涂黑.
(2)D元素的简单离子的离子结构示意图________
(3)B、E形成的气态氢化物的熔沸点那个高________,(用具体的化学式表示).
(4)E与C或F均能形成一些化合物,据有关资料E与C能形成化合物EC6,E能与F能形成化合物E2F2.请回答下面问题:
①甲同学通过分析认为EC6此物质不可能在O2中燃烧,原因是:________,
②乙同学通过查资料知化合物E2F2中既存在极性键,又存在非极性键,试写出其电子式:________;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式:________
查看答案和解析>>
科目: 来源:福建省安溪一中、惠安一中、养正中学2010-2011学年高二下学期期末联考化学试题 题型:022
[化学-有机化学基础]
聚丙烯酸钠(![]() )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如下:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如下:
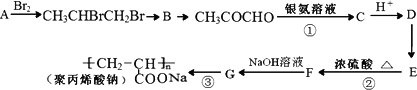
(1)A的名称为________,B中官能团的名称是________.
(2)物质E的结构简式是________.
(3)反应②、③的反应类型分别为________、________.
(4)反应①发生的化学方程式为________.
(5)写出符合下列条件的F的同分异构体(不考虑顺反异构)的结构简式________.
a.链状分子
b.与新制氢氧化铜在加热条件下反应生成红色沉淀
c.与NaOH溶液混合后滴入酚酞,加热,溶液颜色变浅
查看答案和解析>>
科目: 来源:河北省冀州中学2010-2011学年高二下学期第三次月考化学试题 题型:022
据香港《壹周刊》报道,国际影星成龙代言的“霸王”品牌旗下的中草药洗发露、首乌黑亮洗发露以及追风中草药洗发水,经过香港公证所化验后,发现均含有被美国列为致癌物质的二恶烷(![]() ).
).
(1)二恶烷别名二氧六环(1,4-二氧己环),为无色液体,稍有香味,主要用作溶剂、乳化剂、去垢剂等,其分子式为________.
(2)二恶烷可以由原料A制备,制备流程如下所示:
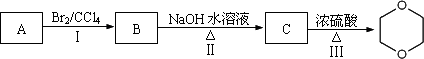
请回答下列问题:
①A的结构简式为________,C的名称是________.
②Ⅰ的反应类型是________,Ⅲ的反应类型是________.
③Ⅱ的化学方程式为________,Ⅲ的化学方程式为________.
(3)二恶烷的同分异构体D既能发生水解反应,又能发生银镜反应,写出D的结构简式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com