
科目: 来源:山东省济宁市金乡二中2011-2012学年高二下学期期中考试化学试题 题型:022
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此时该混合溶液中下列关系中,一定正确的是________.
a.c(H+)·c(OH-)=1×10―14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0.
Ca2+(aq)+A2-(aq) ΔH>0.
①温度降低时,Ksp________(填“增大”、“减小”或“不变”,下同).
②滴加少量浓盐酸,c(Ca2+)________.
Ⅱ、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-.为使废水能达标排放,作如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(4)欲使10 L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O.
(5)若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为________.(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
科目: 来源:黑龙江省哈师大附中2011-2012学年高二下学期第一次月考月考化学试题 题型:022
莽草酸是合成治疗禽流感的药物-达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下图:
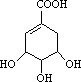
请回答:
(1)写出A分子中官能团的名称________.
(2)该有机物分子1 mol最多能和________mol NaOH发生反应.
以下是以A为原料的有机合成路线:
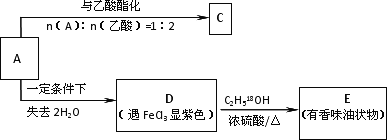
已知D的碳环上一氯代物只有两种.回答下列问题:
(3)C有三种结构,写出其中一种的结构简式:________.
(4)A→D的反应类型为________.
(5)写出下列反应的化学方程式:
①D与足量的NaHCO3溶液反应:________.
②D→E:________.
查看答案和解析>>
科目: 来源:黑龙江省哈师大附中2011-2012学年高一4月月考化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)的CaO.
(1)Ca元素在周期表中位置是________,其原子结构示意图________.
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为________,比A与Si形成的化合物为E.D的沸点比E的沸点________(填“高”或“低”).
(3)配平化学方程式:________P+________FeO+________CaO-________Ca3(PO4)2+________Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为________(填名称);检测Mn+的方法是________(用离子方程式表达).
(5)取1.6 g钙线试样,与水充分反应,生成448 mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3________g.
查看答案和解析>>
科目: 来源:福建省厦门六中2011-2012学年高二下学期期中考试化学试题 题型:022
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体.
该变化过程的离子反应方程式为________
向这种液体中加入Mg(OH)2固体,产生的现象为________
(2)不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体可能是________(填化学式).
(3)在配制FeCl3溶液时,为防止浑浊,应加入________(填化学式).
(4)写出FeCl3溶液各离子浓度由大到小的顺序是________.
(5)常温下,PH=5的FeCl3溶液与PH=5的盐酸其中水电离的c(H+)之比为________
查看答案和解析>>
科目: 来源:福建省厦门六中2011-2012学年高二下学期期中考试化学试题 题型:022
工业合成氨与制备硝酸一般可连续生产,流程如下:

(1)工业生产时,制取氢气的一个反应为:CO+H2O![]() CO2+H2,
CO2+H2,
①t℃时,往1 L密闭容器中充人0.2 mol CO和0.3 mol水蒸气,反应建立平衡后,体系中c(H2)=0.12 mol·L-1,该温度下此反应的平衡常数K=________;(请填数字不必带单位)
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=________.
(2)合成塔中发生反应为:
N2(g)+3H2(g)![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0
下表为不同温度下该反应的平衡常数.由此可推知,表中T1________573K(填“>”、“<”或“=”).
在生产中,若要增大H2的转化率,在其他条件不变的情况下可以采取的措施为________(填字母).
A.加入一定量H2
B.加入一定量N2
C.将生成的气体NH3液化分离
D.升高温度
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2![]() 4NO+6H2O;△H=-905 kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因________.
4NO+6H2O;△H=-905 kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因________.
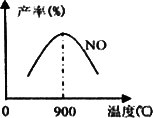
(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是________
2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是________
查看答案和解析>>
科目: 来源:山东省济宁市泗水一中2011-2012学年高二3月月考化学试题 题型:022
如下图装置闭合电键K时,电流计A的指针将发生偏转.试回答:
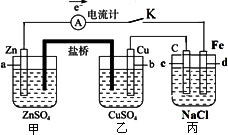
(1)丙池是________(填“原电池”或“电解池”),甲中a极电极名称是________,丙中c极电极名称是________;
(2)乙中Cu极的电极反应是________,若电路中有0.02 mol电子通过,则甲中a电极溶解的质量为________g;
(3)闭合电键K一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的化学方程式是________;
(4)丙池中反应进行较长时间后,收集到标准状况下氢气2.24 L此时测得丙池溶液质量实际减少4.23 g,含有碱0.100 mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是________mol;
(5)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进________.
查看答案和解析>>
科目: 来源:安徽省安工大附中、红星中学2011-2012学年高二3月联考化学试题 题型:022
F是新型降压药替米沙坦的中间体,可由下列路线合成:
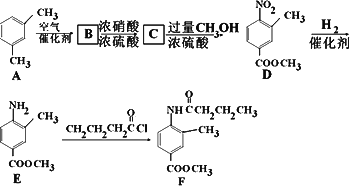
(1)反应类型:D→E:________,E→F:________.
(2)写出满足下列条件的B的所有同分异构体________(写结构简式).
①含有苯环
②含有酯基
③能与新制Cu(OH)2反应
(3)C中含有的官能团名称是________.已知固体C在加热条件下可溶于甲醇,下列C→D的有关说法正确的是________.
a、D的化学式为C9H9NO4
b、浓硫酸的吸水性可能会导致溶液变黑
c、甲醇既是反应物,又是溶剂
(4)E的同分异构苯丙氨酸经缩聚反应形成的高聚物是________(写结构简式).
(5)F在强酸和长时间加热条件下发生水解反应的化学方程式是________.
查看答案和解析>>
科目: 来源:浙江省余姚中学2011-2012学年高二第一次质检化学试题(实验班) 题型:022
有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如下图所示.已知:A的碳链无支链,且1 molA能与4 mol Ag(NH3)2OH完全反应;B为五元环酯.

已知:
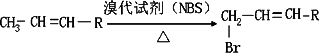
(1)A中所含官能团是________.
(2)B结构简式为________.
(3)写出下列反应方程式并指出反应类型(有机物用结构简式表示)
G→H________;反应类型________.
由G生成高分子________;反应类型________
A→I________;反应类型________
查看答案和解析>>
科目: 来源:福建省厦门六中2011-2012学年高一下学期期中考试化学试题 题型:022
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)②、④、⑤的原子半径由大到小的顺序为________.②、④、⑤的离子半径由大到小的顺序为________.
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是________(填化学式).
(3)②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为________.
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为________.
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为________.
(6)④⑤两元素相比较,金属性较强的是________(填名称),用原子结构知识解释________,可以验证该结论的实验是________(填编号).
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量.
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
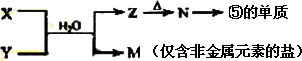
X溶液与Y溶液反应的离子方程式为________.
查看答案和解析>>
科目: 来源:江西省上高二中2011-2012学年高一下学期第二次月考化学试题 题型:022
Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中![]() =________
=________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:________
(3)平衡时,N的转化率为________.
(4)下列叙述中能说明上述反应达到平衡状态的是________
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
Ⅱ、(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143 kJ·g-1.则燃烧1 mol H2放出的热量为________kJ.
(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的O=O分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放________kJ的能量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com