
科目: 来源:江苏省盐城中学2011-2012学年高二下学期期中考试化学试题 题型:022
Ⅰ.铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示.
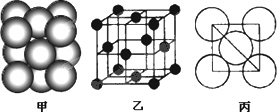
(1)由图可知,金属晶体铂的堆积方式为________,一个晶胞中含有________个铂原子,距离每个铂原子最近且等距离的铂原子有________个.
Ⅱ.铂元素的一种化合物:PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(2)PtCl2(NH3)2是________(填写选项字母);A平面四边形结构,B四面体结构
(3)请在下面空格内画出淡黄色固体分子的几何构型图:

(4)黄绿色固体物质是由________组成(填“极性分子”或“非极性分子”);
(5)两种固体在水中的溶解性差异,可以用________原理来解释;
(6)NH3中的N-H键是________(填写选项字母);
A.sp3-s σ键
B.sp2-s σ键
C.sp3-p σ键
D.sp3-s π键
Ⅲ.碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物.
碳铂的结构为: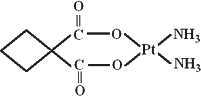
(7)化学键种类很多,如:
A.极性共价键
B.非极性共价键
C.配位键
D.离子键
E.金属键
F.σ键
G.π键.碳铂中含有的作用力有________(填数字).
①ABCFG
②ABDF
③ACEG
④DE
(8)在碳铂分子中,C原子的杂化方式有________种.
查看答案和解析>>
科目: 来源:江苏省盐城中学2011-2012学年高二下学期期中考试化学试题 题型:022
(1)根据VSEPR模型:
ClO3-的价层电子对的几何分布呈________型,离子的空间结构呈________型;
CH2Cl2的价层电子对的几何分布呈________型,分子的空间结构呈________型;
(3)按要求写出由第三周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体形分子________,三角锥形分子________,V形分子________;
(4)与SO42-互为等电子体的微粒(举两例)________;
(5)金属钠的晶胞如下图所示,实验测得钠的密度为d(g·cm-3).已知钠的相对原子质量为M,阿伏加德罗常数为NA(mol-1),假定金属钠原子
为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为________;

查看答案和解析>>
科目: 来源:北京市师大附中2011-2012学年高二下学期期中考试化学试题 题型:022
煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在25℃、101 kPa时,H2与O2化合生成1 mol H2O(g)放出241.8 kJ的热量,其热化学方程式为________.
又知:①C(s)+O2(g)=CO2(g); ΔH=-393.5 kJ/mol
②CO(g)+1/2 O2(g)=CO2(g); ΔH=-283.0 kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)=CO(g)+H2(g);ΔH=________kJ/mol.
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
CO2(g)+H2(g);ΔH<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
①该反应的平衡常数表达式为________.
②平衡时,甲容器中CO的转化率是________;
容器中CO的转化率;乙________甲;丙________甲.(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度________(填“升高”或“降低”).
查看答案和解析>>
科目: 来源:河北省衡水中学2011-2012学年高二下学期三调考试化学试题 题型:022
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
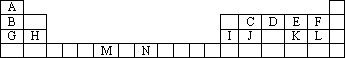
试回答下列问题:
(1)请写出元素N的基态原子电子排布式________.
(2)D的氢化物易溶于水的原因________.
(3)D和E的电负性的大小:________>________.(用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有________个σ键,________个π键.
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________(填元素符号),其中一种金属的晶胞结构如下图所示,该晶胞中含有金属原子的数目为________.
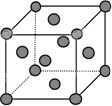
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是________(填“极性”或“非极性”)分子.
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取 sp2杂化的分子有________(填序号),CS2分子的空间构型是________.
查看答案和解析>>
科目: 来源:吉林省长春市十一高2011-2012学年高一下学期期中考试化学试题 题型:022
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.
请用化学用语回答:
(1)推断B元素在元素周期表中的位置________,写出C的单质的电子式________.
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为________.
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是________.(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程________.
(5)下图为某新型发电装置示意图,其负极电极反应为________.
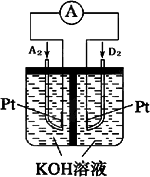
查看答案和解析>>
科目: 来源:四川省南山中学2011-2012学年高二五月月考化学试题 题型:022
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶.制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)甲中不含氧原子的官能团名称是________;下列试剂能与甲反应而退色的是________(填标号).
a.Br2/CCl4溶液
b.石蕊溶液
c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:________.
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):
淀粉A的分子式是________,试剂X可以是________.
(4)已知:
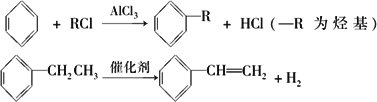
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________.
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110.丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种.则丁的结构简式为________.
查看答案和解析>>
科目: 来源:河北省张家口沽源一中2012届高三高考预测化学试题 题型:022
芳香化合物A、B互为同分异构体,B的结构简式是CH3COO-![]() -COOCH2CH3
-COOCH2CH3
A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示:

(1)B可以发生的反应类型有(填序号)________.
①加成反应
②酯化反应
③消去反应
④取代反应
⑤聚合反应
B的核磁共振氢谱中会出现________个峰.
(2)E中含有官能团的名称是________.
(3)A有两种可能的结构,其对应的结构简式为________,________.
(4)B、C、D、F、G化合物中互为同系物的是________.
(5)F与H在浓硫酸作用下加热时发生反应的方程式为________.
查看答案和解析>>
科目: 来源:广西桂林市第十八中学2011-2012学年高二下学期期中考试化学理科试题 题型:022
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:

(1)A物质的结构简式为:________;J中所含的含氧官能团的名称为________.
(2)E与H反应的化学方程式是________;反应类型是________.
(3)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的化学方程式是________.
(4)写出符合下列性质的J的所有同分异构体的结构简式.①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种.
________
查看答案和解析>>
科目: 来源:重庆市西南大学附属中学2011-2012学年高二下学期期中考试化学试题 题型:022
硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有滑腻感,可做润滑剂.硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面.回答下列问题:

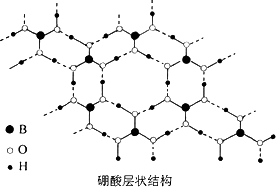
(1)B原子结构示意图为________.
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O![]() [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式________.
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式________.
(3)下列有关硼酸晶体的说法正确的是________.
A.H3BO3分子的稳定性与氢键有关
B.平均1 mol H3BO3的晶体中有3 mol氢键
C.硼酸晶体中层与层之间作用力是范德华力
D.B为sp2杂化,同一层内主要作用力是共价键和氢键
(4)根据对角线规则,与B性质相似的元素是________.
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是________.
A.HClO
B.H4SiO4
C.H3PO4
D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=________;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数):________.
查看答案和解析>>
科目: 来源:重庆市西南大学附属中学2011-2012学年高二下学期期中考试化学试题 题型:022
前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2.
(1)X的元素符号为________,Z元素位于周期表第________周期第________族.
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式).
(3)Z的最高价氧化物的水化物的化学式为________.
(4)12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的σ键数目为________.
(5)含W元素的最高化合价的含氧酸根离子是________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com