
科目: 来源:黑龙江省哈尔滨市第六中学2012-2013学年高一下学期期末考试(化学) 题型:022
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:黑龙江省哈尔滨市第六中学2012-2013学年高一下学期期末考试(化学) 题型:022
Ⅰ有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与溴的四氯化碳溶液发生加成反应,1 mol A能与1 mol NaHCO3溶液恰好完全反应.B所含元素种类与A相同,是厨房的调味品,其中碳的质量分数为52.2%,氢的质量分数为13%.试回答下列问题.
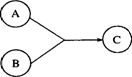
(1)A中所含官能团的名称为________.
(2)B的分子式为________,B的同系物D的相对分子质量为60,则D可能的结构简式为(写一种)________,D催化氧化的方程式为:________.
(3)A与B反应生成C的化学反应方程式为________,该反应属于________反应.
Ⅱ.有机化合物的结构简式可进一步简化,如:CH3CH2CH2CH3可表示为![]()
①该物质的名称为![]() ________.
________.
②该物质的分子式为: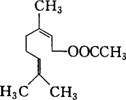 ________.
________.
③该物质加聚反应的方程式为(用结构简式表示)![]() ________.
________.
④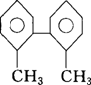 最少________个碳原子处于同一平面上.
最少________个碳原子处于同一平面上.
查看答案和解析>>
科目: 来源:吉林省长春外国语学校2011-2012学年高二下学期期末考试化学试题 题型:022
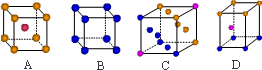
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:

①三种元素电负性大小关系为________.
②写出Y原子的电子排布式________Y的第一电离能大于Z的第一电离能的原因________.
③X晶体采用下列________(填字母) 堆积方式.
(2)N2O的等电子体为:①分子________,②阴离子________;由此可知N2O的中心原子的杂化类型为________.根据价层电子对互斥模型确定NO2的分子构型为:________.
(3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,
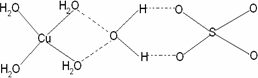
请在图中标出水合铜离子中的配位键.
查看答案和解析>>
科目: 来源:吉林省长春外国语学校2011-2012学年高二下学期期末考试化学试题 题型:022
(1)熔点沸点HF________HI;原因:________.
(2)各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为________.
(3)下列4种物质熔点沸点由高到低排列为________(填序号).
①金刚石(C-C)②锗(Ge-Ge)
③晶体硅(Si-Si)④金刚砂(Si-C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如下图所示.晶体中每个Na+同时吸引着________个Cl-,由这些Cl-构成的几何构型为________晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个.

(5)某元素的激发态原子的电子排布式为1s22s22p63s23p34s1,则该元素基态原子的电子排布式为________;其最高价氧化物对应的水化物的化学式是________.
(6)某元素原子的价电子构型为3d104S2,它属于第________周期,是________族,________区元素,元素符号是________.该原子核外有________个能级,电子云的形状有________种.
查看答案和解析>>
科目: 来源:吉林省长春外国语学校2011-2012学年高一下学期期末考试化学试题 题型:022
已知W、X、Y、Z为四种短周期元素,原子序数逐渐增大.其中W形成的单质是自然界中最轻的气体;X原子的最外层电子数是次外层电子数的2倍;Y元素是地壳中含量最多的元素;Z元素是短周期中原子半径最大的元素.回答下列问题:
(1)X6W6的结构简式为________,分子空间构型为________.
(2)Y与Z形成的两种常见化合物的电子式分别为________和________.
(3)由W、X、Y三种元素形成的最简式为XW2Y的化合物有A和B两种,其中A的相对分子质量是60,是日常生活中的一种调味品的主要成分,则A的结构简式为________;B的相对分子质量是A的3倍,在正常人的血液里含有0.1%的B,则B的分子式________.将B物质的溶液与新制的Cu(OH)2悬浊液共热,观察到得现象是________.
(4)将B在酒化酶的作用下可制得另外一种具有特殊香味的液态有机物C,同时得到一种能导致温室效应的气体.写出该反应的化学方程式________.
(5)C是一种可以再生的清洁燃料,写出其燃烧的化学方程式________.C还可以在Cu或Ag的催化作用下被氧气氧化成具有刺激性气味的液体,该反应的化学方程式为________.
查看答案和解析>>
科目: 来源:云南省玉溪一中2011-2012学年高二下学期期末考试化学试题 题型:022
(1)在一定温度下,向1 L体积固定的密闭容器中加入1 mol A(g),发生反应2A(g)![]() B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
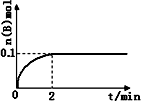
a.平衡常数
b.A的平衡浓度
c.平衡时混合气体的密度
d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大.
a.NaNO3
b.CuSO4
c.Na2SO4
d.NaHSO3
e.CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为________.
(4)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________.
查看答案和解析>>
科目: 来源:湖北省孝感高中2011-2012学年高一下学期期中考试化学试题 题型:022
有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.
①A元素最外层电子数是次外层电子数的2倍.
②B的阴离子和C的阳离子与氖原子的电子层结构相同.
③在通常状况下,B的单质是气体,0.1 mol B的气体与足量的氢气完全反应共有0.4 mol电子转移.
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质.
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应.
请写出:
(1)A元素的最高价氧化物的电子式________.
(2)B元素在周期表中的位置________.
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有________.
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为________.
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的________.
(6)元素D与元素E相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填选项序号).
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目: 来源:上海市黄浦区2013年高考一模化学试题 题型:022
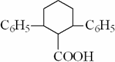
已知由有机物B、苯甲醛、乙酸、乙醇合成目标产物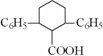 ,其合成路线如下图所示(其中Et表示乙基).
,其合成路线如下图所示(其中Et表示乙基).
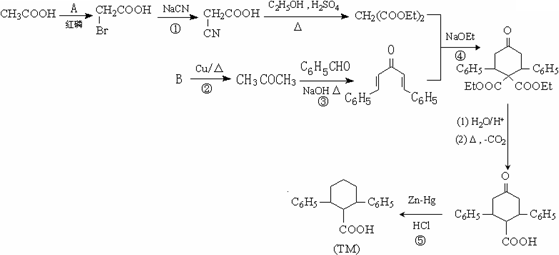
完成下列填空:
1.写出反应类型:反应④________、反应⑤________.
2.写出物质A的分子式________,B的名称是________.
3.写出下列反应的化学方程式:②________.③________.
4.C9H10O是苯甲醛的同系物,其中苯环上含有两个取代基的同分异构体共有________种,写出其中一种的结构简式________.
5.如果只用一种试剂通过化学反应(必要时可以加热)鉴别合成原料中的乙酸、乙醇、苯甲醛.这种试剂是________,其中苯甲醛检出的现象是________.
6.目标产物(结构如图)是否有含三个苯环的同分异构体________(填“有”或“无”),理由是________.
查看答案和解析>>
科目: 来源:浙江省金华一中2011-2012学年高二下学期期中考试化学试题 题型:022
完成下列各题:(1).在T1℃时,向容积为2 L的密闭容器甲中加入1 mol N2、3 mol H2及少量固体催化剂,发生反应N2(g)+3H2(g)![]() 2NH3(g);ΔH<0,10 min时各物质的浓度不再变化,测得NH3的物质的量为0.4 mol.
2NH3(g);ΔH<0,10 min时各物质的浓度不再变化,测得NH3的物质的量为0.4 mol.
①该反应在0~10 min时间内H2的平均反应速率为________N2的转化率为________.
②在T1℃时,若起始时在容器甲中加入0.5 molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为( )(填选项字母)
a.大于0.4 mol
b.等于0.4 mol
c.小于0.4 mol
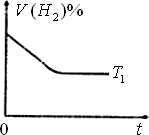
③下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T1℃(T2>T1)时的H2体积分数随时间t的变化曲线.
(2)已知:Al3+与HCO3?/SUP>、CO32?/SUP>、HS-、S2-等能发生彻底的双水解,生活中通常利用Al3+与HCO3?/SUP>的反应来制作泡沫灭火器.泡沫灭火器的简易构造如下图,a为玻璃瓶,b为铁筒,请思考:
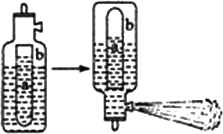
①参与反应的液体分别为Al2(SO4)3和NaHCO3,请问a瓶中盛放的液体为:________.
②为了保证泡沫灭火器的使用寿命,通常在Al2(SO4)3溶液中加入另一种物质抑制硫酸铝的水解,请问该物质是________.
③已知苯酚是比碳酸更弱的酸,请问,苯酚钠和硫酸铝能否发生彻底的双水解?如能,请写出该反应的离子反应方程式:________.
查看答案和解析>>
科目: 来源:贵州省湄潭中学2011-2012学年高一下学期期中考试化学试题 题型:022
下表是元素周期表的一部分,回答下列有关问题:
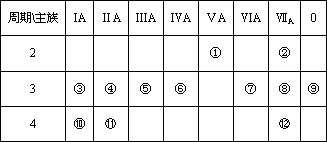
(1)写出下列元素符号:④________;K________.
(2)画出原子的结构示意图:⑤________;J________.
(3)在①~K元素中,金属性最强的元素是________,非金属性最强的元素是________,最不活泼的元素是________.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成________(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为________该氧化物中含有的化学键是________键(填“离子”或“共价”)
(7)在一定条件下,若将元素①的单质和氢气的混合气体通入4 L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4 mol,则用元素①的单质表示的反应速率为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com