
科目: 来源:高中化学习题1 题型:022
无水氯化铝是白色晶体,易吸收水分,在178℃升华.装有无水氯化铝时试剂瓶久置于潮湿的空气中,会自动爆炸并产生大量白雾.氯化铝常作为有机合成和石油化工的催化剂,并用于处理润滑剂等.工业上用金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用而制得.
某课外兴趣小组在实验室里,通过如下图所示装置制取少量纯净的无水氯化铝.
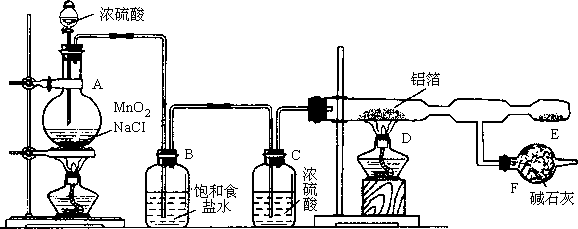
(1)开始实验时,不能先点燃A装置的酒精灯,后打开分液漏斗的活塞,而是先将适量浓硫酸注入烧瓶后再加热,其理由是__________________;
(2)A装置发生反应的化学方程式为_______________;
(3)在E处可收集到纯净的氯化铝,其原因是_________________;
(4)A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是_______________________;
(5)装置F所起的作用是__________________;
(6)无水氯化铝在潮湿空气中会产生大量白雾,有关反应化学方程式为____________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,![]() 和
和![]() 的用量可自由控制).
的用量可自由控制).
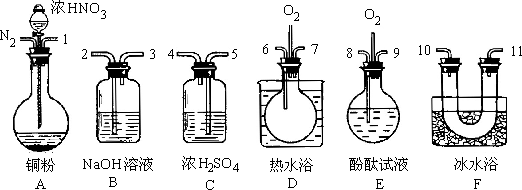
已知:①![]()
②气体液化温度;![]() 21℃ NO -152℃
21℃ NO -152℃
试回答:
(1)仪器的连接顺序(按左右连接,填各接口的编号)为__________________.
(2)反应前先通入![]() ,目的是________________.
,目的是________________.
(3)确认气体中含NO的现象是______________.
(4)装置F的作用是______________.
(5)如果![]() 过量,则装置B中发生反应的化学方程式为:______________.
过量,则装置B中发生反应的化学方程式为:______________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
接触法制硫酸的化学反应为:
![]()
![]()
![]()
![]()
![]()
![]()
本法最后的产品为质量分数为98%硫酸或20%发烟硫酸(![]() 和
和![]() 的混合物,其中
的混合物,其中![]() 的质量分数为20%).
的质量分数为20%).
(1)若98%硫酸可表示为![]() ,20%发烟硫酸可表示为
,20%发烟硫酸可表示为![]() ,则
,则![]() 的值(
的值(![]() 可用分数表示)分别是:
可用分数表示)分别是:![]() .
.
(2)用![]() 分别表示
分别表示![]() 转化成上述两种硫酸时,所用水的质量与
转化成上述两种硫酸时,所用水的质量与![]() 的物质的量的关系式(即求k),分别是:
的物质的量的关系式(即求k),分别是:
![]() .
.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
如图所示装置,A、B中的为多孔的惰性电极;C、D为夹在湿的![]() 滤纸条上的铂夹;电源有a、b两极.若在A、B中充满
滤纸条上的铂夹;电源有a、b两极.若在A、B中充满![]() 溶液后倒立于盛有
溶液后倒立于盛有![]() 溶液的水槽中.切断
溶液的水槽中.切断![]() ,闭合
,闭合![]() ,通直流电.则:
,通直流电.则:
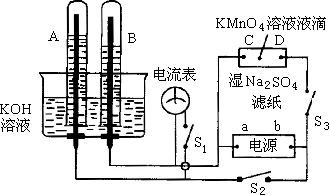
(1)标出电源的正负极,a为________极,b为________极.
(2)在湿的![]() 溶液滤纸条中心的
溶液滤纸条中心的![]() 液滴,发生的现象是________________.
液滴,发生的现象是________________.
(3)写出电极反应式:A中____________,B中_______________.
(4)若电解一段时间后,A、B中均有气泡包围电极.此时切断![]() ,闭合
,闭合![]() ,则电流表的指针________(填“会”或“不会”)移动,理由是:________________.
,则电流表的指针________(填“会”或“不会”)移动,理由是:________________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
阿伏加德罗常数的测定有多种方法,其中电解法是常用的方法.请回答下列有关问题:
现有同样浓度的![]() 等溶液.若实验过程中不考虑电极上的析出物与电解后的溶液之间的反应,则你认为选用哪一种溶液作为电解液,使得实验既简便、测定结果误差又小:________.
等溶液.若实验过程中不考虑电极上的析出物与电解后的溶液之间的反应,则你认为选用哪一种溶液作为电解液,使得实验既简便、测定结果误差又小:________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
以A、B两根石墨为电极,电解硝酸银溶液,通电t min后,在B极收到集到22.4mL(标况)气体,然后将电源反接,以相同电流强度通电![]() min,两极质量变化分别为A极__________________________,B极____________,若溶液体积为200mL(设体积不变),则溶液的pH为________.
min,两极质量变化分别为A极__________________________,B极____________,若溶液体积为200mL(设体积不变),则溶液的pH为________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
在量热计中(如图)将100mL 0.50mol/L的![]() 溶液与100mL 0.55mol/L
溶液与100mL 0.55mol/L![]() 溶液混合,温度从298.0K升高到300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J/K,溶液密度均为1g/mL,生成溶液的比热容
溶液混合,温度从298.0K升高到300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J/K,溶液密度均为1g/mL,生成溶液的比热容![]() J/(g·K).
J/(g·K).
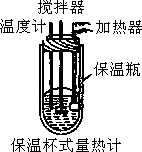
(1)试求![]() 的中和热
的中和热![]() .
.
(2)![]() 的中和热的文献值为-56.1kJ/mol,你认为(1)中测得的实验值偏差可能的原因是__________________.
的中和热的文献值为-56.1kJ/mol,你认为(1)中测得的实验值偏差可能的原因是__________________.
(3)实验中![]() 过量的目的是________________.
过量的目的是________________.
(4)你认为![]() 的中和热与
的中和热与![]() 的中和热数值相比,________较大,其原因是________________________.
的中和热数值相比,________较大,其原因是________________________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
美国《科学美国人》杂志在1971年7月刊登的“地球的能量资源”一文中提供了如下数据.

请选用以上数据计算:
(1)地球对太阳能的利用效率为________.
(2)通过光合作用,每年有________kJ的太阳能转化为化学能.(每年按365天计算)
(3)每年由绿色植物能过光合作用(![]() )为我们生存的环境除去二氧化碳的质量为m,试根据能量关系列出m的计算式:
)为我们生存的环境除去二氧化碳的质量为m,试根据能量关系列出m的计算式:
![]() ;所缺数据的化学含义为_____________________.
;所缺数据的化学含义为_____________________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
火箭推进器中盛有强还原剂液态肼(![]() )和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热,已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量.
)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热,已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量.
(1)写出该反应的热化学方程式________________________.
(2)又已知![]() ,则16g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ.
,则16g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___________________________.
查看答案和解析>>
科目: 来源:高中化学习题1 题型:022
向100mL 1mol/L硫酸铝铵![]() 溶液中,逐滴加入1mol/L的
溶液中,逐滴加入1mol/L的![]() 溶液.
溶液.
(1)当生成沉淀的物质的量的总量最大时的离子方程式是(用一个离式方程式表示)__________________________________.
(2)随着![]() 溶液的加入,沉淀总的物质的量(Y轴)与
溶液的加入,沉淀总的物质的量(Y轴)与![]() 溶液的体积(X轴)的关系如图所示,则A、C两点对应的
溶液的体积(X轴)的关系如图所示,则A、C两点对应的![]() 溶液的体积为:
溶液的体积为:
A ________mL C ________mL

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com