
科目: 来源:活题巧解巧练·高考化学(第一轮) 题型:043
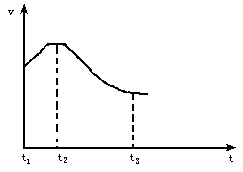
把除去氧化膜的镁条插入到盛有稀盐酸的试管中,发现氢气发生的速率变化情况如下图所示,其中t1~t2速率变化的主要原因是________,t2~t3速率变化的主要原因是________.
查看答案和解析>>
科目: 来源:活题巧解巧练·高考化学(第一轮) 题型:043
同温同压下取三份等体积的无色气体A,于25℃,80℃,90℃测得其摩尔质量分别为58.0g/mol,20.6g/mol,20.0g/mol.再于25℃,80℃,90℃下各取1dm3(气压相同)上述无色气体分别溶于10dm3水中,形成的溶液均显酸性.
(1)无色气体为________.
(2)各温度下摩尔质量不同的原因.
(3)若三份溶液的体积相等,其物质的量浓度的比值是多少.
查看答案和解析>>
科目: 来源:2001~2002学年度第二学期形成性练习 题型:043
长期存放的![]() 可能会部分氧化成
可能会部分氧化成![]() ,现实验测定某无水
,现实验测定某无水![]() 样品的纯度.
样品的纯度.
步骤如下:
①称量a g样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解;
③加入稀盐酸,使溶液呈强酸性,再加入过量![]() 溶液;
溶液;
④过滤后,用蒸馏水洗涤沉淀;
⑤加热干燥沉淀;
⑥将沉淀冷却至室温后,称量;
⑦重复⑤、⑥操作到合格,最后得b g固体.
试回答:
(1)实验中是否能用![]() ________,原因是________.
________,原因是________.
(2)③中加盐酸至强酸性的目的是________.
(3)⑦中“合格”标准是________.
(4)样品中![]() 的质量分数是(列出算式不必化简)________.
的质量分数是(列出算式不必化简)________.
查看答案和解析>>
科目: 来源:知识精讲与能力训练 高三化学 题型:043
用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3·5H2O.Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl![]() S↓+SO2↑+H2O+2NaCl现取15.1g Na2SO3溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以使硫能被水浸润),加到上述溶液中,用小火加热至微沸,反应约1h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体.
S↓+SO2↑+H2O+2NaCl现取15.1g Na2SO3溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以使硫能被水浸润),加到上述溶液中,用小火加热至微沸,反应约1h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体.
(1)若加入的硫粉不用乙醇润湿,对反应的影响是(填写选项字母,可以多选,但选错要倒扣).
[ ]
A.会降低反应速率
B.需要提高反应温度
C.将增大反应体系的pH值
D.会减少产量
(2)反应1h后过滤,其目的是________.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是________,它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是________.
(4)设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30ml,该溶液是否达到饱和?试通过计算说明.(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3.)
(5)若要计算在100℃下将溶液蒸发至体积为30.0ml,再冷却至10℃时所能得到的Na2S2O3·5H2O的质量,你认为________.(填写一个选项字母)
A.前面提供的数据足够.
B.还需要提供100℃时溶液的密度(1.14g/cm3).
C.还需提供结晶后剩余溶液的体积(10mL).
(6)根据第(5)小题你的选择(如选A则直接计算;如选B或C则可选用其数据),计算从10℃、30.0mL溶液中结晶而出的Na2S2O3的质量.
查看答案和解析>>
科目: 来源:知识精讲与能力训练 高三化学 题型:043
完成有关反应的化学方程式
试写出用食盐、水、石灰石、焦炭为原料合成聚氯乙烯,并制备漂白粉的有关反应的化学方程式.(已知:CaO+3C![]() CaC2+CO↑)
CaC2+CO↑)
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:043
以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH).
已知两个醛分子在一定条件下自身加成.下式中反应的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得:(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
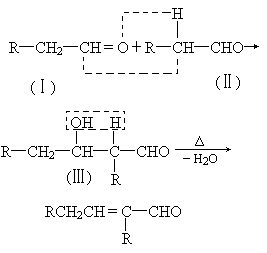
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件).
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:043
将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管中与混合液的接触处有闪烁的红光出现.这是因为通气后混合液中产生的ClO-被H2O2还原,发生剧烈的反应,产生能量较高的氧分子,它立即转变为普通氧分子,将其多余的能量红光放出.收集生成的红光,测得其波长为λ=0.6000μm.用此红光做光电效应的实验.已知光电效应实验中,阴极板用极限频率为γ0=6.000×1014Hz的钠制成.
(1)在导管口与混合液的接触处除观察到红光外还有________现象.
(2)题中需要约10% H2O2溶液100mL,现用市售30%(密度近似1g·cm-3)H2O2来配制,写出具体配制方法.
(3)写出题中发生反应的离子方程式.
(4)能否产生光电效应?计算回答.
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:043
下表表示出某藻类植物细胞液及海水中的离子浓度,分析回答:
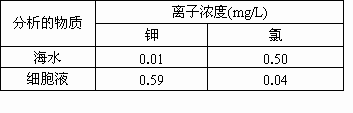
(1)该种藻类的细胞从海水吸收钾的方式是________,原因是________.
(2)该植物细胞对钾、氯的吸收具有________的特性,之所以吸收钾多,吸收氯少,这是因为细胞膜上________.
(3)要电解该种海水制得5mg Cl2,需要海水多少升?除得到Cl2外,还得到哪种气体?有多少毫摩?
查看答案和解析>>
科目: 来源:高考三人行 化学 题型:043
渤海沿岸海滩平缓,多细沙,日照时间长,因此全国最大的盐场均集中于此,试解答下列问题:
(1)制海盐的方法如下:海水涨潮时,将海水引入盐田,等落潮时,再用日晒的方法,待盐田水分蒸发到一定程度时,再撒入食盐颗粒(称为晶种),食盐晶体即从饱和溶液中析出.渤海沿岸为什么会成为全国盛产海盐的盐场?
(2)以食盐为主要原料可以制备纯碱.试用化学方程式表示其制备过程.
(3)工业上用电解饱和食盐水来制备火碱和盐碱称之为氯碱工业.写出工业上用立式隔膜电解槽电解饱和食盐水的总的化学方程式.
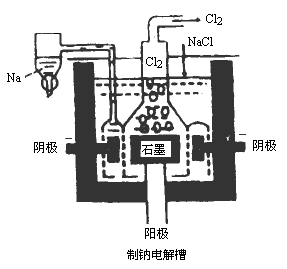
(4)工业上用电解法制备金属钠,电解槽如上图所示.电解槽的外壳是钢,内部衬以耐火砖.槽中有石墨阳极和铸钢阴极,电极间隔4cm.电解液为熔融的NaCl和CaCl2,含40% NaCl和60% CaCl2,电解时操作温度约为580℃,金属钠和钙在阴极产生,浮在融盐浴上并经垂直管上升流入收集器,回答下列问题:
①电解液不是采用纯净的熔融的NaCl,而采用NaCl和CaCl2的共熔物,在这里CaCl2称之为助熔剂,它的作用是______________________________________________.
②已知NaCl的熔点为803℃,电解时实际操作温度为580℃左右,降低电解操作温度有两个优点,这两个优点是:______________________________________________.
查看答案和解析>>
科目: 来源:黄冈重点作业·高二化学(下) 题型:043
已知某些醛类之间可以聚合生成羟醛,例如:
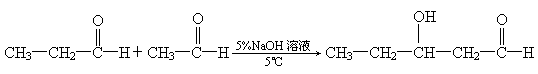
羟醛受热很容易脱水生成不饱和醛.试写出以乙炔为原料(无机试剂可以任选),合成正丁醇的化学方程式:________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com