
科目: 来源:广东省惠阳高级中学2010-2011学年高一下学期期末考试化学试题 题型:058
某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质,设计了如下的实验装置图:
(一)制取纯净的氯气

(1)写出A中反应的化学方程式:________.
(2)B中加入的物质是:________作用是:________.
(3)C中加入的物质是:________作用是:________.
(4)E中反应方程式为:________.
(二)验证氯气的性质:

(1)B中发生反应的方程式为:________.
(2)C中发生反应的方程式为:________.
(3)D中的反应方程式为:________.
查看答案和解析>>
科目: 来源:山东省邹城一中2010-2011学年高二下学期期末考试化学试题 题型:058
从今年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从绍兴、宁波、台州地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素.
Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100 mg碘,
假设此碘盐碘元素含量为40 mg/kg,要达到上述碘含量要求,需服用该碘盐________kg,你觉得服用碘盐防辐射合理吗?________Ⅱ.下图为某加碘盐标签的一部分.

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量
,进行以下实验:步骤
1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液.步骤
2:取一支50 mL碱式滴定管,用b mol·L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:

(1)第一次读数为
________mL.(2)滴定终点的判断方法________.
(3)经过计算,此加碘盐碘元素的含量为________mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏低的是
________.A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5 g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
查看答案和解析>>
科目: 来源:安徽省肥西农兴中学2010-2011学年高二上学期期末考试化学试题 题型:058
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:

(1)方框内装置用来制取乙烯,其中包括的仪器是:
①碎瓷片
②石棉网和铁架台
③圆底烧瓶
④温度计(量程100℃)
⑤温度计(量程200℃)
⑥酒精灯
⑦单孔塞
⑧双孔塞
⑨导管.不选用的仪器有________(填编号).
(2)写出制乙烯化学方程式:________.
(3)碱石灰的作用是:________.
(4)实验过程中,发现溴水会褪色,可能的原因是:________.
(5)出现什么现象可说明生成了乙烷?________.
查看答案和解析>>
科目: 来源:海南省海南中学2010-2011学年高一下学期期末考试化学试题(2-20班) 题型:058
用下图所示实验装置制取乙酸乙酯.回答以下问题:
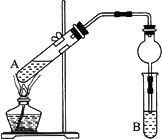
(1)在A试管中配置好体积比为3:2的乙醇和乙酸,加热至沸腾,很久都末有果香味液体生成,原因是________.
(2)B试管中所装溶液应为________,乙酸乙酯生成后,将在该溶液的________(填“上”或“下”)层,分离出产品所需的主要仪器是________.
(3)与教材采用的实验装置不同,这位老师采用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处,球形干燥管的作用有①________,②________.
查看答案和解析>>
科目: 来源:山东省济南市重点中学2010-2011学年高二下学期期末考试化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省济南市重点中学2010-2011学年高二下学期期末考试化学试题 题型:058
用实验室准确配制的0.100 mol/L的NaOH溶液测定某未知浓度的稀盐酸.
其具体实验步骤如下:
①取一支碱式滴定管(下图中有两只滴定管,你选择哪一只?)________(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100 mol/L的NaOH溶液并记录液面刻度读数;

②用酸式滴定管精确地放出25.00 mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入酚酞试液2滴;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,当锥形瓶内溶液由________(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
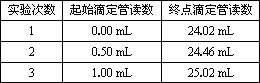
测得未知稀盐酸的物质的量浓度为________(保留小数点后3位).
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果稀盐酸浓度的影响是________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目: 来源:学习高手选修化学(反应原理人教版) 人教版 题型:058
取6根铁钉,6支干净的试管及其他材料,准备如下图
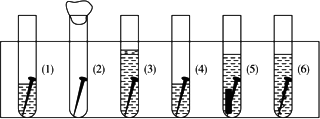
试管(1)放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管(2)的试管底放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触.
试管(3)先放入一根铁钉,趁热倒入煮沸的蒸馏水(赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触.
试管(4)中放入铁钉注入食盐水,使铁钉和空气及食盐水接触.
试管(5)放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片.
试管(6)放入相连的铁钉和铜丝,注入自来水浸没铁钉和铜丝.
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况.其中________试管内的铁钉未被腐蚀.从铁钉被腐蚀的情况可知引起和促进铁钉腐蚀的条件是________.
查看答案和解析>>
科目: 来源:选修高手化学苏教·化学反应原理 苏教版 题型:058
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤.
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤.
步骤3:将步骤2中得到的固体溶于足量的稀硫酸.
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥.
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、________、________等玻璃仪器.
(2)步骤1过滤的目的是________.
(3)当步骤2中的溶液pH=8-9时,检验沉淀是否完全的方法是________.
(4)步骤2中溶液的pH控制较难操作,可改用________.
查看答案和解析>>
科目: 来源:选修高手化学苏教·化学反应原理 苏教版 题型:058
50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________.
(2)烧杯间填满碎纸条的作用是_________.
(3)若大烧杯上不盖硬纸板,求得中和热数值_________(填“偏大”“偏小”或“无影响”).
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________(填“相等”或“不相等”),简述理由_________.
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________;用0.50 mol·L-1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会_________(填“偏大”“偏小”或“无影响”).
查看答案和解析>>
科目: 来源:山东省济南外国语学校2010-2011学年高一下学期期末考试化学试题 题型:058
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
实验目的:制取乙酸乙酯
实验原理:甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了做吸水剂和脱水剂的作用外还有________
装置设计:甲、乙、丙三位同学分别设计了下列三套实验装置:

请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是________(选填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是________
实验步骤:(1)按选择的装置组装仪器,在试管中先加入3 ml乙醇,2 ml冰醋酸,并在摇动下缓缓加入2 ml浓硫酸充分摇匀,(2)将试管固定在铁架上;(3)在试管②中加人适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验.
问题讨论:a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:
无色油状液体、________;
b.试管②中饱和Na2CO3的作用是溶解乙醇、降低乙酸乙酯的溶解度还有________的作用
c.从试管②中分离出乙酸乙酯的实验操作是________
d.生成乙酸乙酯的化学反应方程式________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com