
科目: 来源:新疆乌鲁木齐八中2010-2011学年高一下学期期末考试化学试题 题型:058
分别取1 mol葡萄糖进行下列实验:
(1)银镜反应时,需银氨溶液________mol,反应后葡萄糖变为________,其结构简式为________.
(2)与醋酸反应生成酯,从理论上讲完全酯化需________g醋酸.
(3)若使之全部转化为CO2和H2O,所需氧气的体积在标准状况下为________L,反应的化学方程式为________
(4)与新制的Cu(OH)2反应的现象是________.
查看答案和解析>>
科目: 来源:新疆乌鲁木齐八中2010-2011学年高一下学期期末考试化学试题 题型:058
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
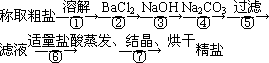
(1)判断BaCl2已过量的方法是________.
(2)第④步中,相关的离子方程式是________;________.
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是________.
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是________.
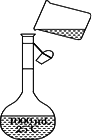
查看答案和解析>>
科目: 来源:北京市东城区2010-2011学年高一下学期期末考试化学试题 题型:058
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.

(1)过氧化氢分解的化学方程式为________.
(2)实验①的目的是________.
实验中滴加FeCl3溶液的目的是________.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是________(用实验中所提供的几种试剂).
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是________.

(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察________,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是________.
查看答案和解析>>
科目: 来源:北京市东城区2010-2011学年高一下学期期末考试化学试题 题型:058
“铝热反应”的化学方程式为:2Al+Fe2O3 Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据分别如下:
Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据分别如下:
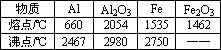
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是:________.
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________,当观察到________现象时,说明熔融物中含有金属铝.
(3)实验室溶解该熔融物,最好选用下列试剂中的________(选填字母序号).
a.浓硫酸
b.稀硫酸
c.稀硝酸
d.氢氧化钠溶液
查看答案和解析>>
科目: 来源:云南省玉溪一中2010-2011学年高一下学期期末考试化学试题 题型:058
某化学课外小组用下图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.

(1)写出A中反应的化学方程式:________.
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________.
(3)C中盛放CCl4的作用是________.
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表.

查看答案和解析>>
科目: 来源:浙江省苍南中学2010-2011学年高二下学期期末考试化学试题 题型:058
水中的NO![]() 是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一.检测水中的NO
是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一.检测水中的NO![]() 可用比色法,其步骤是:
可用比色法,其步骤是:
a.配制标准溶液:称取0.30 g NaNO2,溶于水后在容量瓶中稀释至1 L得溶液A,移取5 mL溶液A,稀释至1 L,得溶液B.
b.配制标准色阶:取6只规格为10 mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10 mL,再加入少许(约0.3 g)对苯磺酸粉末,实验结果如下表所示:

c.检测:取10 mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比.
请填写以下空白:
①比色法的基本依据是________;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO![]() 含量为________mg/L.
含量为________mg/L.
③用NaNO2直接配制溶液B的缺点是________.
④如果水样显色后比6号还深,应采取的措施是________.
查看答案和解析>>
科目: 来源:浙江省苍南中学2010-2011学年高二下学期期末考试化学试题 题型:058
本世纪是生命科学研究的昌盛时期,科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O![]() ),进而引发产生一系列自由基.一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护.人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O
),进而引发产生一系列自由基.一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护.人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O![]() 含量,原理是O2-与羟胺反应生成NO
含量,原理是O2-与羟胺反应生成NO![]() 和一种过氧化物.NO
和一种过氧化物.NO![]() 在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530 nm处有显著吸收,且其吸收值与c(NO
在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530 nm处有显著吸收,且其吸收值与c(NO![]() )成正比,从而可计算出样品中的O
)成正比,从而可计算出样品中的O![]() 含量.某实验室用以上方法处理后测得溶液中c(NO
含量.某实验室用以上方法处理后测得溶液中c(NO![]() )=2.500×10-3 mol·L-1.
)=2.500×10-3 mol·L-1.
(1)请根据测定原理写出有关反应的离子方程式________;
(2)计算该样品此时c(O![]() )=________;
)=________;
(3)如用羟胺氧化法测定O![]() 时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
①请写出其测定原理的反应方程式________;
②测定所用的主要玻璃仪器为________,滴定终点的现象为:________
查看答案和解析>>
科目: 来源:浙江省苍南中学2010-2011学年高二下学期期末考试化学试题 题型:058
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2:向处理过的铁屑中加入过量的3 mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
第一节在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号)
①铁架台
②燃烧匙
③锥形瓶
④广口瓶
⑤研钵
⑥玻璃棒
⑦酒精灯
第二节在步骤2中所加的硫酸必须过量,其原因是________;
第三节在步骤3中,“一系列操作”依次为________、________和过滤;
第四节本实验制的的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+的方法是________.
查看答案和解析>>
科目: 来源:山西省康杰中学2010-2011学年高二下学期期中试题化学试卷 题型:058
用如图所示装置完成乙炔的制备和性质实验.在最后一支试管的橡胶塞中用尖嘴导管排出尾气并燃烧.
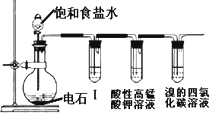
(1)实验开始前,首先要________,制取乙炔的化学方程式是________.
(2)试管Ⅰ中的溶液是________,目的是________.
(3)乙炔通入酸性KMnO4溶液中观察到的现象是________,乙炔发生了________反应;乙炔通入溴的CCl4溶液中发生了________反应;
(4)乙炔燃烧时的实验现象是________.
查看答案和解析>>
科目: 来源:云南省蒙自高级中学2010-2011学年高二上学期期末考试化学B试题 题型:058
乙酰水杨酸是一种人工合成的常用药物,以乙烯和邻氯苯甲醛为原料合成乙酰水杨酸的流程如下:
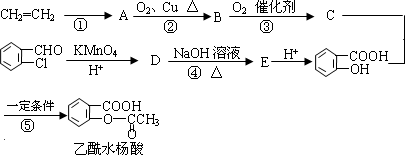
(1)A的结构简式为________,D的结构简式为________.
(2)C中的官能团符号是________.
(3)步骤
④中的反应类型有________、________.(4)写出步骤
⑤的化学方程式:________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com