
科目: 来源:甘肃省兰州一中2011-2012学年高二下学期期中考试化学试题 题型:058
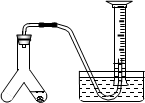
在室温和大气压强下,用图示的装置进行实验,测得a g含CaC290%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
(1)CaC2的电子式:________.
(2)CaC2和水反应的化学方程式是________.
(3)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由________.
(4)本实验中测量气体体积时应注意的事项是________.
(5)实验时防止乙炔泄漏,试剂添加和使反应开始进行应该如何操作?
________
(6)如果电石试样质量为c g,测得气体体积为d L,则电石试样中CaC2的质量分数计算式w(CaC2)=________.(写出简单计算过程,杂质所生成的气体体积忽略不计).
查看答案和解析>>
科目: 来源:四川省金堂中学2011-2012学年高一下学期期中考试化学试题 题型:058
A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式________.
(2)还原性强弱:Cm-________E(m-1)-(填“>”或“<”);能证明其还原性强弱的离子方程式为:________.
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:________.
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式________.在该溶液中溶质中含有的化学键类型是________.
(5)在A、B、C、E单质中,符合下列转化关系的是________(填元素符号).
查看答案和解析>>
科目: 来源:四川省金堂中学2011-2012学年高一下学期期中考试化学试题 题型:058
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(1)定性分析:如图甲可通过观察________,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________,写出H2O2在MnO2作用下发生反应的化学方程式:________.
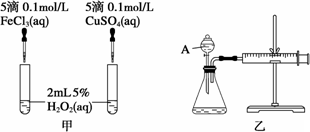
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为________,实验中需要测量的数据是________.
查看答案和解析>>
科目: 来源:四川省金堂中学2011-2012学年高二下学期期中考试化学试题 题型:058
化学键的键能是指气态原子间形成1 mol化学键时释放的能量.如:H(g)+I(g)→H-I(g)+297 KJ即H-I键的键能为297 kJ/mol,也可以理解为破坏1 mol H-I键需要吸收297 KJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.下表是一些键能数据.(单位:kJ/mol)
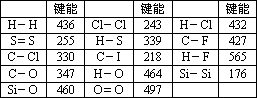
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性________(填“大于”或“小于”)CF4的稳定性.试预测C-Br键的键能范围________<C-Br键能<________
(2)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点.你是否赞同这种观点?如不赞同,请说出你的解释.________.
(3)已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,请写出表示氢气燃烧热的热化学方程式:________.
查看答案和解析>>
科目: 来源:四川省金堂中学2011-2012学年高二下学期期中考试化学试题 题型:058
用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用________(填编号字母)作指示剂.
(A)甲基橙
(B)石蕊
(C)酚酞
(2)若选用甲基橙作指示剂,滴定终点的判断方法是________,此时溶液显________性.
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1.
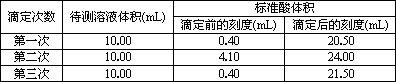
(4)分析下列实验操作会对滴定结果产生的影响.(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________.
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________.
③若烧碱溶液隔夜后滴定,选用甲基橙作指示剂时,则滴定结果________.
查看答案和解析>>
科目: 来源:山东省济南世纪英华实验学校2011-2012学年高一下学期期中考试化学试题 题型:058
实验室用下列仪器和药品制取干燥纯净的氯气.

(1)、按气流从左到右,装置正确的连接顺序为( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
(2)装置F的作用是________,装置E的作用是________.
(3)装置A和E中的反应化学方程式为
A________.
E________.
(4)某校化学兴趣小组称取8.7 g二氧化锰与足量10 mol/L的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=________ L
(5)若该小组量取了10 mol/L的浓盐酸40 ml,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1________V2(填“>”、“<”或“=”),原因是________.
查看答案和解析>>
科目: 来源:宁夏银川一中2011-2012学年高二下学期期中考试化学试题 题型:058
传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高.随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善.某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
(1)用________(填仪器名称)量取10.00 mL氨水样品,在________(填仪器名称)中用一定量蒸馏水稀释后转移到100 mL________(填仪器名称)中(洗涤液也转入),加蒸馏水,最后用________(填仪器名称)定容、混匀后,将所得溶液装入试剂瓶备用.
(2)量取20.00 mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统.如果锥形瓶中含有少量蒸馏水,是否会影响测量结果________(填“是”、“否”、“不能确定”),理由是________.
(3)向锥形瓶中滴加0.1000 mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图(见下图).
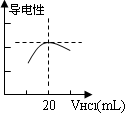
①滴定管盛放盐酸前,要先________,然后用蒸馏水冲洗2至3次,再用________,然后才能盛放盐酸.滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的________.
②氨水与盐酸反应的离子方程式为________.
③该氨水样品的物质的量浓度为________mol·L-1.
(4)另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使![]() 浓度下降,这样,恰好完全反应时
浓度下降,这样,恰好完全反应时![]() 浓度不是最大值,溶液导电性就不会是最大值.
浓度不是最大值,溶液导电性就不会是最大值.
①你认为学习小组乙的结论是否正确?________(填“正确”、“不正确”)
②当溶液导电能力达到最大时,溶液中各离子浓度大小的关系是________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2011-2012学年高一下学期期中考试化学试题 题型:058
某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:

(1)该反应的化学方程式为________.
(2)反应开始至2 min,以气体Z表示的平均反应速率为________.
(3)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的________倍.
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时________(填“增大”“减小”或“相等”).
查看答案和解析>>
科目: 来源:江苏省扬州中学2011-2012学年高一下学期期中考试化学试题 题型:058
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态).
(1)化学反应中的ΔH是以________的形式体现的.对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为________0(填“大于”.“小于”),该反应是________(填“放热”或“吸热”)反应.
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关.
已知:298 K时,H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ·mol-1 ΔH(H2)=436 kJ·mol-1,ΔH(Cl2)=247 kJ·mol-1.则ΔH(HCl)=________.
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)=2Fe( s)+3CO2(g) ΔH=-25 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2011-2012学年高一下学期期中考试化学试题 题型:058
Ⅰ、亚硫酸钠中的硫元素为+4价,请选择下面所提供的化学试剂,设计简单的实验,证明亚硫酸钠既有氧化性,又有还原性.(所提供的试剂为:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、NaOH溶液、氨水)
(1)要说明Na2SO3具有氧化性,应选用的试剂是________反应的离子方程式是________,观察到的现象是________.
(1)要说明Na2SO3具有还原性,应选用的试剂是________,反应的离子方程式是________,所观察到的现象是________.
Ⅱ、某亚硫酸钠试剂已被部分氧化.为了确定它的纯度,要进行如下实验:
①称取样品a g;
②将样品溶解;
③在溶液中加入稍过量的盐酸酸化的BaCl2溶液;
④将沉淀过滤,洗涤、干燥后称重,质量为b g.试回答:
(1)BaCl2溶液要用盐酸酸化的原因是________;
(2)BaCl2溶液要稍过量的原因是________;
(3)判断沉淀是否洗尽的方法是________;
(4)Na2SO3样品纯度的计算式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com