
科目: 来源:广东省珠海市2011-2012学年高二下学期期末考试化学试题 题型:058
羟基是重要的官能团.某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性.
①碳酸
②乙醇
③苯酚
④乙酸
Ⅰ.甲同学设计并实施了如下实验方案.

Ⅱ.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示.

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)________中,B管插入________中,C管插入________中.
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善.
查看答案和解析>>
科目: 来源:内蒙古包头三十三中2011-2012学年高一下学期期末考试化学试题 题型:058
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:
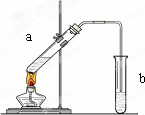
(1)写出制取乙酸乙酯的化学反应方程式________.
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:________.
(3)浓硫酸的作用是:①________;②________.
(4)饱和碳酸钠溶液的主要作用是________.
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止________.
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是________.
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是________.
查看答案和解析>>
科目: 来源:内蒙古包头三十三中2011-2012学年高二下学期期末考试化学试题 题型:058
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物.
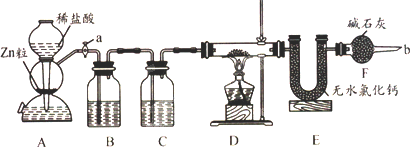
(1)如何检查装置A的气密性________.
(2)为了安全,在点燃D处的酒精灯之前,在b处必须________.
(3)装置B的作用是________,装置C中装的液体是________.
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生的化学反应方程式是________.
(5)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后,U型管的质量增加7.2 g则混合物中Fe2O3的质量为________.
查看答案和解析>>
科目: 来源:江西省吉安二中2011-2012学年高二下学期期中考试化学试题 题型:058
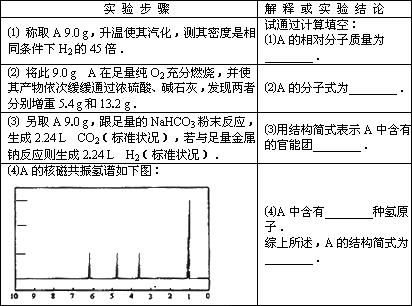
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
查看答案和解析>>
科目: 来源:江西省吉安二中2011-2012学年高二下学期期中考试化学试题 题型:058
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
[观察与思考]
(1)乙醇分子的核磁共振氢谱有________个吸收峰.
[活动与探究]
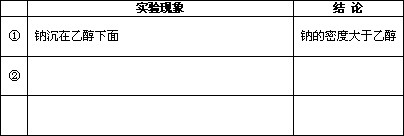
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满).
(3)乙同学向试管中加入3~4 mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次.则此时乙醇发生反应的化学方程式为________.欲验证此实验的有机产物,可以将产物加入盛有________的试管中并在酒精灯火焰上直接加热,观察现象即可,此反应的化学方程式为________.
[交流与讨论]
(4)丙同学向一支试管中加入3 mL 乙醇,然后边摇动试管边慢慢加入2 mL浓硫酸和2 mL冰醋酸,按下图所示连接好装置,请指出该装置的主要错误是________.假如乙醇分子中的氧原子为18O原子,则发生此反应后1 8O原子将出现在生成物________中(填字母).
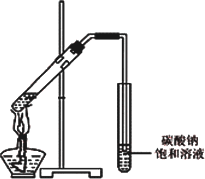
A、水
B、乙酸乙酯
C、水和乙酸乙酯
查看答案和解析>>
科目: 来源:湖南省衡阳七校2011-2012学年高二上学期期末质量检测化学试题 题型:058
实验室用下图装置制取少量溴苯,试填写下列空白.
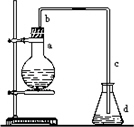
(1)在烧瓶a中装的试剂是________、________、________.
(2)请你推测长直导管b的作用:________.
(3)请你分析导管c的下口不能浸没于液面中的原因是________.
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色难溶于水的液体,简述获得纯净的溴苯应进行的实验操作:________.
查看答案和解析>>
科目: 来源:湖南省衡阳七校2011-2012学年高二上学期期末质量检测化学试题 题型:058
实验测得,某有机物相对分子质量为72.
(1)若该有机物是烃,其分子式为________,它有________种同分异构体.若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为________.
(2)若该有机物3.6 g完全燃烧生成0.15 mol CO2和0.1 mol H2O,则该有机物的分子式为________.若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):________,若它是一种不饱和酯,该酯发生加聚反应的生成物的结构简式为________.
查看答案和解析>>
科目: 来源:浙江省绍兴一中2011-2012学年高二下学期期末考试化学试题 题型:058
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO
+6HCHO![]() 3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g.
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀.
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察________.
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
④滴定达到终点时的现象:________.
(2)滴定结果如下表所示:
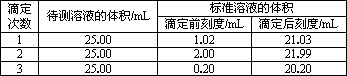
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________.
查看答案和解析>>
科目: 来源:陕西省宝鸡中学2011-2012学年高一下学期期中考试化学试题 题型:058
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:陕西省宝鸡中学2011-2012学年高二下学期期中考试化学试题 题型:058
阅读下列实验内容,根据题目要求回答问题.
某学生为测定未知浓度的硫酸溶液,实验如下∶用1.00 mL待测硫酸配制100 mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 5.00 mL,滴定终止时消耗NaOH溶液15.00 mL.
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下∶
A、用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂.
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)________;
②该滴定操作中应选用的指示剂是________;
③在G操作中如何确定终点?________.
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)________.
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是________
(4)如有1 mol/L和0.1 mol/L的NaOH溶液,应用________的NaOH溶液,原因是________.
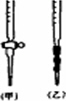
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入________(选填“甲”或“乙”)中.
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值________(选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com