
科目: 来源: 题型:058
下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出),图中:A为无水乙醇(沸点78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液。

(1)在上述装置中,实验时需要加热的仪器按加热的先后顺序排列为 (填仪器或某部位的代号)。
E处是一种纯净物,其发生反应的化学方程式为 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是 。D处使用碱石灰的作用是 。
(3)能证明乙醇反应的产物的实验现象是
(4)图中G处导管倾斜的作用是
(5)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同,推断B处发生反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:058
纯碱中常含有少量的NaCl等杂质,利用下图仪器装置可用来测定纯碱中Na2CO3的质量分数。
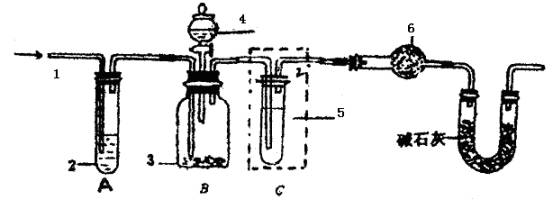
图中:1.空气 2.某溶液 3.纯碱 4.稀硫酸 6.碱石灰
其实验步骤是:
a.按上图所示,组装好实验仪器,并检查其气密性;
b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g);
c.准确称量一定量的纯碱(设为n g);并将其放进广口瓶内;
d.从分液漏斗中缓缓滴入一定量稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止。
e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验,回答下列问题:
(1)该实验进行至操作d时,要缓缓鼓入空气,鼓入空气的作用是 。装置A中盛装的液体“2”应选用 ;装置A的作用是 。如果撤去装置A,直接向装置B中缓缓鼓入空气,则会导致实验测定结果 (填偏大、偏小和不变)。
(2)在空白格内画出装置C及试剂;装置C盛放的试剂“5”是 ;说明装置C的作用是 ;如果撤去装置C,则会导致实验测定结果 。(填偏大、偏小和不变)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为 (用m1、m2、n表示)。
(4)装置E的作用是 。
查看答案和解析>>
科目: 来源: 题型:058
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH。有关的有机试剂的沸点如下:
CH3COOC2H5:77.1℃; C2H5OH:78.3℃; C2H5OC2H5(乙醚):34.5℃; CH3COOH:118℃
实验室合成乙酸乙酯粗产品的步骤如下:
在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)反应中加入的乙醇是过量的,其目的是: 。
(2)边滴加醋酸、边加热蒸馏的目的是: 。
将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向产品中加入(填字母) 。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)再向其中加入饱和氯化钙溶液,振荡、分离,其目的是:
。
(5)然后再向其中加入无水硫酸钠,振荡,其目的是:
。最后,将经过上述处理后的液体放入另一干燥的蒸馏瓶内,再蒸馏,弃去低沸点馏分,收集沸程76~78℃之间的馏分即可。
查看答案和解析>>
科目: 来源: 题型:058
有BaCl2样品,其中含有少量的Mg2+(约2%,以MgCl2计)。为了准确测定其纯度,采用盐酸测定方法,主要实验步骤如下:
①首先称取样品W g,配成溶液;②然后加入V1 mL浓度为C1 mol•L-1的氢氧化钠溶液(过量);③充分沉淀后加入指示剂,再用浓度为C2 mol·L-1的标准盐酸滴定过量的碱,用去盐酸V2 mL。试回答:
(1)若滴定前要滤去氢氧化镁沉淀,为了保证测定的准确性,过滤时应注意什么?
(2)若选用适当的酸碱指示剂,也可以不必过滤就滴定,选用哪种指示剂?不必过滤的原因是什么?
(3)试样BaCl2纯度的计算公式如何表示?
提示:测定某物质的纯度,往往通过测杂质的含量来进行。这是一种常用的测定方法。
查看答案和解析>>
科目: 来源: 题型:058
1820年德贝尔纳首次使用MnO2作催化剂加热分解KClO3制O2,当时就发现气态产物有异常气味,后来证明因其中含有少量的Cl2和O3(臭氧)等杂质。已知O3的氧化性比O2更强,且与还原剂起反应时通常生成O2。又知碳酸钴(CoCO3)在加热条件下与氧气反应,可表示为:
x![]() +
+![]()
![]()
![]() x
x![]() +CoxOy(褐色)
+CoxOy(褐色)
现利用下列装置测定CoxOy的组成。

请填写下列空白:
(1)E装置中的U形管内盛放的物质是:
A.五氧化二磷 B.无水氯化镁 C.无水硫酸铜 D.碱石灰
(2)若实验装置中,接口a与b直接连接,而不用B、C装置,这样会导致测定结果出现误差,其原因是 。
(3)B洗气瓶内所盛放的物质是 。
A.NaOH溶液 B.饱和NaHCO3溶液
C.饱和NaCl溶液 D.KI溶液
(4)实验结束时,首先撤去A装置部分的酒精灯,会引起 。
(5)CoCO3完全转化为褐色的CoxOy后,称得E管增重4.4 g,D管内残留的物质的质量是8.3 g,据此可推知褐色物质(CoxOy)中x∶y= 。
查看答案和解析>>
科目: 来源: 题型:058
实验室用下图装置制取溴化亚铁。其中A为CO2发生装置。D和d中均盛有液溴。E为外套电炉丝的不锈钢管,e是两只耐高温的瓷皿,其中共盛有56 g细铁粉。实验开始时先将铁粉加热至600~700℃然后将干燥、纯净的CO2气流通入D中,E管中反应开始,最后将d中液溴滴入100~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80 g。请回答:
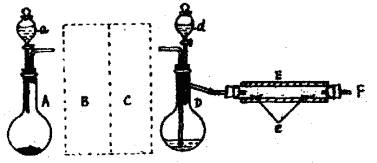
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性?
答: 。
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为 。若在A中盛固体CaCO3,a中盛6 mol•L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为 ,C为 。
(3)实验时装置D和E的橡皮塞最好用铝箔包住,原因是 。
(4)反应过程中要不断通入CO2,其主要作用是:① ,② 。
(5)E中的反应为:2Fe+3Br2=2FeBr3,2FeBr3 = 2FeBr2+Br2↑,求此实验中溴化亚铁的产率: 。
(6)为防止污染空气,实验时应在F处连接盛 的尾气吸收装置。
查看答案和解析>>
科目: 来源: 题型:058
以六水合氯化镁(MgCl2·6H2O)为原料制备无水MgCl2。已知:MgCl2·6H2O晶体在空气中加热时,释出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥的HCl气流中加热能制得无水MgCl2。可选择的药品:MgCl2·6H2O晶体、NaCl(固)、KClO3(固)、MnO2、浓H2SO4、浓HCl、稀NaOH溶液。仪器见下图(装置可重复使用)。

回答下列问题:
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B……填入)是 ,有关的化学方程式是 ;
(2)按HCl气流方向,其余装置的连接顺序(用数字1、2……填入)是:( )→( )
( )→( )( )→( )( );
(3)各装置中应放的药品是:A ,B ,C ,D ,E 。 (4)B装置的作用是 ,B中能观察到的现象是 。
查看答案和解析>>
科目: 来源: 题型:058
(1)取2份体积均为V1 mL含NaOH、Na2CO3的溶液。往第一份溶液中加足量BaC12溶液,以酚酞为指示剂,用盐酸(浓度为c1)滴定,达终点时耗V2 mL;第二份以甲基橙为指示剂,用盐酸(浓度为c2)滴定,达终点时耗V3 mL。写出求NaOH、Na2CO3浓度(mol![]() )的算式。
)的算式。
(2)实验步骤同(1),只是第一份用甲基橙作指示剂,第二份用酚酞作指示剂,两份的实验结果如何?请简要说明理由。
查看答案和解析>>
科目: 来源: 题型:058
某化学课外小组所做实验的示意图如下:

上图中,“→”表示气体流向,M是一种纯净而干燥的气体,y为另一种气体,E内有红棕色气体产生,实验所用的物质只能由下列物质中选取:Na2CO3、 Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。
据此实验,完成下列填空
(1)A中所用装置的主要仪器有________________________________________,发生的反应是__________________________________________。
(2)B中所选用的干燥剂是_______________ ,其作用是___________________。
(3)C中所发生的主要反应的化学方程式是_________________________________ 。
(4)制取Y气体的化学方程式是____________________________________ 。
(5)当F中充满气体后,A停止加热,D停止送气,并立即关闭两个活塞,取下试管F并立即倒扣在水槽中,观察到的现象是______________________________ 。
查看答案和解析>>
科目: 来源: 题型:058
下列各组物质,只选用一种试剂就可将它们一一鉴别.
(1)苯、苯酚溶液、乙酸溶液,所用试剂是________.
(2)乙醛、乙酸、乙醇、乙二醇所用试剂是________.
(3)乙酸钠溶液、![]() 溶液、苯酚钠溶液,所用试剂是________.
溶液、苯酚钠溶液,所用试剂是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com