
科目: 来源:物理教研室 题型:058
(1)烧瓶中所发生主要反应的化学方程式是__________________________,(Ⅱ)的烧杯中冷水所起的作用是____________,装置(Ⅲ)的烧杯中液体的作用是_____________。
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为____________________________。
(3)装置(Ⅲ)的烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因。
答:_______________________________________________。

查看答案和解析>>
科目: 来源:物理教研室 题型:058

回答下列问题:
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B……填入)是 ,有关的化学方程式是 ;
(2)按HCl气流方向,其余装置的连接顺序(用数字1、2……填入)是:( )→( )
( )→( )( )→( )( );
(3)各装置中应放的药品是:A ,B ,C ,D ,E 。 (4)B装置的作用是 ,B中能观察到的现象是 。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
①AgNO3(aq) ②稀 HNO3 ③Br2(aq) ④I2(aq) ⑤NaOH(aq) ⑥NaCl(aq) ⑦NaBr(aq) ⑧H2O ⑨Na ⑩Mg条 11Al条 12K
(1)你准备选用的药品是(用编号表示)________。
(2)你所做的实验是什么(用方程式表示)判断依据是什么。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
(2KMnO4+5Na2C2O4+8H2SO4=K2SO4+5Na2SO4+10CO2↑+2MnSO4+8H2O)
查看答案和解析>>
科目: 来源:物理教研室 题型:058
查看答案和解析>>
科目: 来源:物理教研室 题型:058

(1)这些装置的连接顺序(按产物气流由左到右的方向)是(填编号):
→ → → 。
(2)实验中①的A瓶溶液褪色,C瓶溶液不褪色。A的作用是 B的作用是 ,C的作用是
(3)若②中药品是无水硫酸铜粉末,可确证的产物是 ,确定②在整套
装置中的位置的理由是 。
(4)③中溶液是 ,可验证的产物是 。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
①称量![]() g样品,置于烧杯中;②加入适量蒸馏水,使样品溶解;③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液;④过滤,用蒸馏水洗涤沉淀;⑤加热干燥沉淀物;⑥将沉淀物冷却至室温后,称量;⑦重复⑤、⑥操作直至合格,最后得到
g样品,置于烧杯中;②加入适量蒸馏水,使样品溶解;③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液;④过滤,用蒸馏水洗涤沉淀;⑤加热干燥沉淀物;⑥将沉淀物冷却至室温后,称量;⑦重复⑤、⑥操作直至合格,最后得到![]() g固体。
g固体。
回答下列问题:
(1)本实验中是否能用Ba(NO3)。代替BaCl2?其理由是:________。
(2)步骤③中加盐酸使溶液呈强酸性的目的是什么?
(3)步骤⑦的“合格”标准是________。
(4)实验测得样品中无水亚硫酸钠的质量分数是:________。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
①在中性或弱酸性溶液中先用Br2将试样中的I-完全氧化为碘酸盐,煮沸除去过量的Br2之后冷却到室温。
②然后加入过量的KI酸化溶液,用淀粉做指示剂,以求得I-的含量。反应为:
![]() +2
+2![]()
![]() →2I-+
→2I-+![]()
![]()
试回答:
(1)请写出上述过程中①、②中发生反应的离子方程式: ①________;②________。
(2)经上述实验步骤后,若原试样中I-浓度为0.001mol·L-1,最后可放大多少倍________,其浓度应达到________mol·L-1。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
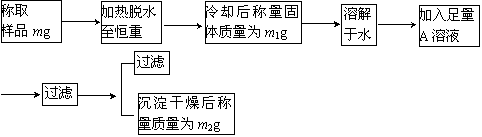
试回答:
(1)加热脱水时,若有固体飞溅出来造成损失,则会使测得的结晶水的含量偏________。加热脱水后,若将样品露置于空气中冷却,则会使测得的结晶水含量偏________。
(2)现有AgNO3、BaCl2、CaCl2、Ba(NO3)2、Ba(OH)2五种溶液,从测定的准确性考虑,可作为A溶液的是________;若加入A溶液的量不足,会使测得的纯度偏________;判断A溶液是否足量的方法是________。
(3)过滤时,应把滤纸上的沉淀洗涤干净,洗涤沉淀的方法是________,若不洗涤,则会使测得的纯度偏________。
(4)通过实验,测得芒硝的化学式中的n值为10,则芒硝的纯度为________%。
查看答案和解析>>
科目: 来源:物理教研室 题型:058
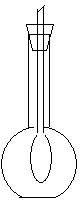
现已用平底烧瓶收集得到CO2,在瓶内有一只扎紧在玻璃管末端的气球,如右图所示。打开塞子迅速往瓶里加入下列物质中的________(填序号),立即塞紧塞子,一段时间后,气球就会自动膨胀起来。
[答案] [提示内容] 此现象表明瓶内的气压变小,气体被消耗。 [详解内容] B.Na2O2 C.KO2 D.RbO3
A.Na2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com