
科目: 来源: 题型:058
我国规定饮用水质量标准必须符合下列要求:
PH 6.5~8.5
Ca2+、Mg2+总浓度 <0.0045mol×L-1
细菌总数 <100个×L-1
下图是源水处理厂自来水的工艺流程示意图:

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰能生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式________。
(2)凝聚剂除去悬浮固体颗粒的过程________(填写编号,多选倒扣)
①只是物理过程②只是化学过程③是物理和化学过程 FeSO4×7H2O是常用的凝聚剂,它在水中最终生成________沉淀。
(3)通入CO2的目的是________和________。
(4)气体A的作用是________。这种作用是基于A和水反应的产物具有_________性。
(5)下列物质中:________可以作为气体A的代用品。(填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
查看答案和解析>>
科目: 来源: 题型:058
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如图的实验装置:
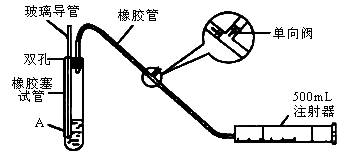
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后________(填写操作方法)时,将会看到________(填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.0005mol×L-1的碘水1.0mL,用适量的蒸馏水稀释后再加入2~3,滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽
气,A溶液由________色变为________色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为________。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
浓度限值/mg×m-3
一级标准
二级标准
三级标准
0.15
0.50
0.70
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,在同一地
点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500mL)。请将下表填写完整(计算时保留2位有效数字):
分组 第一小组 第二小组
抽气次数 120 140
SO2含量/mg×m-3
判断该地点的空气中SO2的含量属于________(填数字)级标准,________(“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)________。
查看答案和解析>>
科目: 来源: 题型:058
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2×6C2H5OH,有关的有机试剂的沸点如下:CH3COOC2H5,77.1℃;C2H5OH,78.3℃;C2H5OC2H5(乙醚),34.5℃;CH3COOH,118℃。实验室合成乙酸乙酯粗产品的步骤如下:
在蒸馏烧瓶内将过量的乙醇和少量的浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏。得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)反应中加入的乙醇是过量的,其目的是______________________。
(2)边滴加醋酸,边加热蒸馏的目的是___________________________。
将粗产品再经下列步骤精制:
(3)除去其中的醋酸,可向产品中加入(填字母)_________________。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)向其中加入饱和氯化钙溶液,振荡、分离。其目的是_____________。
(5)然后再向其中加入无水硫酸钠,振荡。其目的是_________________。
最后,将经过上述处理后的液体放入另一干燥的烧瓶内,再蒸馏,弃去低沸点馏分,收集沸程76~78℃之间的馏分即得乙酸乙酯。
查看答案和解析>>
科目: 来源: 题型:058
实验室制备苯甲醇和苯甲酸的化学原理是:
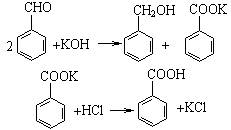
已知苯甲醛易被空气氧化;苯甲醇沸点为205.3℃;苯甲酸熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚(C2H5OC2H5)沸点为34.8℃,难溶于水,制备苯甲醇和苯甲酸的主要过程如下所示:
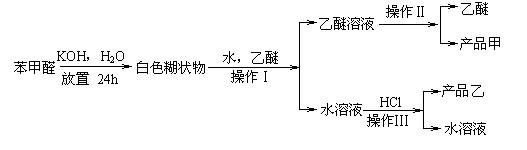
试根据上述信息回答:
(1)操作Ⅰ的名称是____________,乙醚溶液中所溶解的主要成分是___________。
(2)操作Ⅱ的名称是____________。
(3)操作Ⅲ的名称是_____________,产品乙是______________。
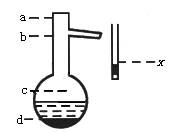
(4)操作Ⅱ中温度计水银球上沿x放置的位置应为_________[图中a,b,c或d],该操作中,除需带支管烧瓶、温度计外,还需的玻璃仪器是___________,收集产品甲的适宜温度为___________。
查看答案和解析>>
科目: 来源: 题型:058
利用乙醇和钠反应来确定乙醇分子中有几个可被置换的H原子是经典的定量实验之一。反应原理:乙醇+钠(足量)→乙醇钠+氢气,所需选用的实验仪器如图(D与F均具有双孔橡皮塞)所示:
(1)气体发生器置于左侧,气体向右方流动,所用仪器与导管依次连接序号为:
( )接( )接( )接( )接( )接( )。

(2)进行实验时的操作如下(每项进行—次):
①从分液漏斗中逐滴把无水酒精加入烧瓶中,并控制反应速度,酒精加完后关闭活塞
②在广口瓶内注入适量水
③待烧瓶冷却到室温后对量筒读数
④把定量的a(mL)无水酒精无损失地倒入分液漏斗中
⑤检查装置的气密性
⑥预先将小块钠块在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,塞紧橡皮塞
⑦估计反应接近完全,用酒精灯对烧瓶略加微热,使反应完成,再撤灯正确操作的序号是_____________________。
(3)出现下列情况时,对实验结果影响怎样?(用A.偏高,B.偏低,C.无影响的代号答题)
①此反应是放热反应,反应速度太快,有部分乙醇挥发,使实验结果_______________。
②如果无水酒精中混合少量甲醇,使实验结果________________。
③读数时,如果量筒内液面高于广口瓶的液面,使实验结果________________。
(4)如果此实验数据视作标准状况的数据:无水乙醇的密度为r(g×cm-3),a(mL)乙醇反应完全后,量筒内的液面读数为b(mL),则一个乙醇分子中能取代出的氢原子数为_____________。
查看答案和解析>>
科目: 来源: 题型:058
图中为苯和溴的取代反应的改进实验装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
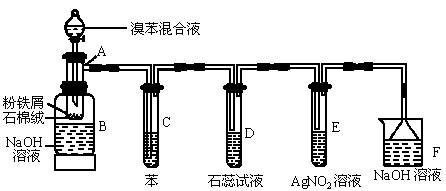
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):___________________________________。
(2)试管C中苯的作用是_________。反应开始后,观察D和E两试管,看到的现象为____________________________________________________。
(3)反应2~3min后,在B中的NaOH溶液里可观察到的现象是______________________________。
(4)在上述整套装置中,具有防倒吸的仪器有_______________________(填字母)。
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是__________________________________。
查看答案和解析>>
科目: 来源: 题型:058
将图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
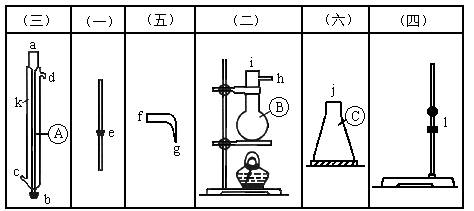
(1)图5(2)—12中A,B,C三种仪器的名称是:_______________。
(2)将以上仪器按(一)→(六)顺序,用字母a,b,c,…表示连接顺序:e接( );( )接( );( )接( );( )接( );( )接( )。
(3)A仪器中c口用于________________,d口用于_______________。
(4)蒸馏时,温度计水银球应在_____________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是________________。
(6)给B加热,收集到沸点为60~150℃间的馏分是____________,收集到150~300℃间的馏分是_____________。
查看答案和解析>>
科目: 来源: 题型:058
某学生用图所示装置(Ⅰ)制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点38.4℃,熔点-119℃,密度为1.46g×cm-3。主要实验步骤如下:
①检查气密性后,向烧瓶中加入一定量苯和液溴。
②向锥形瓶中加入乙醇和浓硫酸的混合液至恰好没于进气导管口。
③将A装置中纯铁丝小心向下插入混合液中。
④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10min。
请填写下列空白:
(1)步骤③中,观察到的现象是____________________。
(2)导管a的作用是_______________________________。
(3)C装置中U形管内用蒸馏水封住管底的作用是_________________________。
(4)反应完毕后,U形管内的现象是_________________;分离出溴乙烷时所用最主要仪器名称是(只填一种)_________________。
(5)步骤④中可否用大火加热,理由是___________________。

(6)为证明溴和苯的上述反应是取代反应而不是加成反应,该学生用装置(Ⅱ)代替装置B,C,直接与A相连接重新反应。
①装置(Ⅱ)的锥形瓶中,小试管内的液体是_____________(填名称),其作用是_______
_________________________________;小试管外的液体是,______________(填名称),
其作用是______________________________。
②反应后,向锥形瓶中滴加________________(填化学式)溶液,现象是______________,其作用是____________;装置(Ⅱ)还可起到的作用是__________________。
查看答案和解析>>
科目: 来源: 题型:058
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸与浓硝酸混合酸时,操作注意事项是_____________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是_______________。
(3)步骤④中洗涤和分离粗硝基苯应使用的仪器是_________________________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是_________________________。
(5)纯硝基苯是无色,密度比水______________(填“小”或“大”),具有___________气味的油状液体。
查看答案和解析>>
科目: 来源: 题型:058
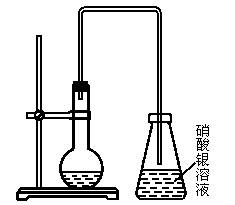
根据实验室制溴苯的装置图,回答下列问题。
(1)烧瓶中加入苯,再加入液溴,现象是:_____________。
(2)再加入铁屑,现象是:_____________。
(3)烧瓶中连接一个长导管的作用是___________。
(4)插入锥形瓶的导管不伸入液面下,其原因_____________________________________。
(5)反应完毕,把烧瓶里的液体倒入盛有冷水的烧杯中,现象是________________________。
(6)提纯粗溴苯的方法________________________________________。纯净的溴苯为__________色,密度比水__________的油状液体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com