
科目: 来源:辽宁省沈阳二中2011届高三10月月考化学试题 题型:058
中学化学常见的物质A、B、C、D之间存在如下转化关系:
A+B→C+D+H2O.请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体,
C、D两种气体均能使澄清石灰水变浑浊,则A与B反应的方程式是________,已知具有刺激性气味的C气体和Cl2都能漂白某些有色物质,如果将两种气体等物质的量通入到品红溶液中的实验现象为________原因是________.
如果将两种气体非等量通入到水中,为了验证哪种气体过量,某兴趣小组的同学准备了以下试剂:①氯化铁溶液
②氯化亚铁溶液
③硫氰化钾溶液
④苯酚溶液
⑤品红溶液
⑥酸性高锰酸钾溶液
若Cl2过量:取适量溶液滴加至盛有________(选填一个序号)试剂的试管内,再加入________(选填一个序号)试剂,发生的现象是:________;
若C过量:取适量溶液滴加至盛有________(选填一个序号)试剂的试管内,发生的现象是:________.
(2)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;C是漂白粉的有效成分,则C发生水解反应的离子方程式是________.
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阳离子的方法是________
________(简述操作过程及结论).
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2010-2011学年高一10月月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:辽宁省沈阳二中2010-2011学年高一10月月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:辽宁省本溪县高级中学2011届高三上学期10月月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:浙江省东阳中学2009-2010学年高一下学期期中考试化学试题 题型:058
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是________,烧瓶中加入的试剂是________.
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用________.
(3)装置B中盛放的试剂是________(选填下列所给试剂的代码),
A.Na2S溶液
B.Na2SO3溶液
C.Na2SO4溶液
实验现象为________,化学反应方程式是________,该反应属于四种基本反应类型中的________反应.
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).________
查看答案和解析>>
科目: 来源:江西省新余一中2009-2010学年高二下学期第二次段考化学试题 题型:058
二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水.
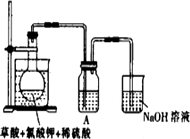
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为
2KClO3+H2C2O4+2H2SO4![]() 2KHSO4+2ClO2↑+2CO2↑+2H2O
2KHSO4+2ClO2↑+2CO2↑+2H2O
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间.控制温度的目的是________________,图示装置中缺少的一种必须的玻璃仪器是________________
②装置A用于溶解产生的二氧化氯气体,其中最好盛放________(填字母).
A.20 mL 60℃的温水
B.100 mL冰水
C.100 mL饱和食盐水
D.100 mL沸水
③在烧瓶中加入12.25 g KClO3和9 g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO![]() ).饮用水中ClO2、ClO
).饮用水中ClO2、ClO![]() 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点.
①步骤1中若要量取20.00 mL水样,则应选用的仪器是________________
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:
2ClO2+2KI![]() 2KClO2+I2,2Na2S2O3+I2
2KClO2+I2,2Na2S2O3+I2![]() Na2S4O6+2NaI,则步骤4中加入的指示剂为________________,滴定达到终点时溶液的颜色变化为________________
Na2S4O6+2NaI,则步骤4中加入的指示剂为________________,滴定达到终点时溶液的颜色变化为________________
③步骤5的目的是使I-将溶液中的ClO![]() 还原为Cl-以测定其含量,该反应的离子方程式为:________
还原为Cl-以测定其含量,该反应的离子方程式为:________
④若饮用水中ClO![]() 的含量超标,可向其中加入适量的Fe2+将ClO
的含量超标,可向其中加入适量的Fe2+将ClO![]() 还原为Cl-,则该反应的氧化产物为________(填化学式)
还原为Cl-,则该反应的氧化产物为________(填化学式)
查看答案和解析>>
科目: 来源:江西省安福中学2009-2010学年高二下学期第二次月考化学试题 题型:058
向溴水中加入足量的乙醛溶液,发现溴水褪色,对“溴水褪色”有以下三种猜想:
①溴水与乙醛发生了取代反应
②溴水与乙醛发生了加成反应
③溴水将乙醛氧化生成了乙酸.
为探究哪种猜想正确,某研究小组提出如下两种实验方案.
方案一:检验褪色溶液的酸碱性
方案二:测定反应前后溴水中Br2的物质的量和Br-的物质的量
问题:
(1)方案一是否可行?________(填“行”或“否”),理由是________________
(2)设反应前溴水中Br2的物质的量为a mol,设反应后溶液中Br-的物质的量为b mol,若是猜想①,则a与b的关系式为________若是猜想②,则b的值为________若是猜想③,则a与b的关系式为________
(3)若取含5×10-3 mol的Br2的溶液与足量的乙醛完全反应,再将反应后的溶液稀释至100 mL,取10 mL溶液加入足量的硝酸银溶液,得到沉淀0.188克,已知CH3COOAg易溶于水,写出溴水与乙醛反应的化学方程式________.
查看答案和解析>>
科目: 来源:江西省安福中学2009-2010学年高二下学期第二次月考化学试题 题型:058
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省如皋市2009-2010学年高二学业水平测试模拟考试化学试题 题型:058
某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
[探究目的]
分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(
稀)=Fe(NO3)3+NO↑+2H2O8Fe+30HNO3(
更稀)=8Fe(NO3)3+3 NH4 NO3+9H2O④3Fe3O4+28HNO3(
稀)=9Fe(NO3)3+NO↑+14H2O[实验探究]
Ⅰ.定性检验

(1)实验③发生的反应的离子方程式为________.
(2)上述实验说明黑色粉末X中含有________.
Ⅱ.定量测定
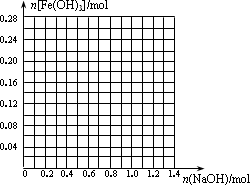
根据下图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是________.
(2)通过以上数据,得出13.12 g黑色粉末X中各成分的物质的量为________.
[交流讨论]
在实验过程中,发现在溶液Y中滴加过量NaOH溶液时有刺激性气味气体生成.为了确定溶液Y中各离子浓度,甲同学重复上述实验.在步骤①中共收集到标准状况下896 mL的气体,经分析其中只含有NO;测得溶液Y中c(H+)
=0.5 mol/L.
通过计算可知,溶液Y中c(Fe3+)=________mol/L,c(NH
请画出在200 mL溶液Y中加入NaOH物质的量与生成的Fe(OH)3沉淀物质的量的关系曲线.
查看答案和解析>>
科目: 来源:河南省郑州市智林学校2009-2010学年高二下学期阶段测试(二)化学试题 题型:058
实验室用加热l-丁醇、溴化钠和浓H2SO4的混合物的方法来制备1-溴丁烷时,还会有烯、醚等副产物生成.反应结束后将反应混合物蒸馏,分离得到1-溴丁烷,已知相关有机物的性质如下:
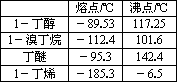
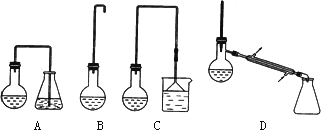
(1)制备1-溴丁烷的装置应选用上图中的________(填序号).反应加热时的温度不宜超过100℃,理由是________.
(2)制备操作中,加入的浓硫酸必需进行稀释,其目的是________.(填字母)
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂.
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是________.该操作应控制的温度(t)范围是________.
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是________.(填字母)
a.NaI
b.NaOH
c.NaHSO3
d.KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com